
| A. | ①②③④ | B. | ①④ | C. | ③④ | D. | ②③ |
分析 ①钠和水反应生成的氢氧化钠和FeCl2溶液发生复分解反应生成Fe(OH)2,最终生成红褐色的Fe(OH)3;
②过量NaOH溶液和明矾溶液混合,反应生成偏铝酸钠,无沉淀产生;
③少量Ca(OH)2投入过量NaHCO3溶液中发生复分解反应有碳酸钙是白色沉淀生成;
④向饱和Na2CO3溶液中通入足量CO2会析出白色的碳酸氢钠晶体.
解答 解:①金属钠投入到烧杯中的FeCl2溶液中,发生的反应为:2Na+2H2O=2NaOH+H2 ↑,2NaOH+FeCl2=Fe(OH)2 ↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以最终生成的沉淀是红褐色的,所以不符合,故错误;
②过量NaOH溶液和明矾溶液混合,发生的反应是:3OH+Al3+=Al(OH)3↓,AlOH3+OH-=AlO2-+2H2O,所以最终没有沉淀生成,故错误;
③少量Ca(OH)2投入过量NaHCO3溶液中发生的反应为:Ca(OH)2+2NaHCO3=CaCO3 ↓+2H2O+Na2CO3,碳酸钙是白色沉淀,所以有白色沉淀生成,故正确;
④向饱和Na2CO3溶液中通入足量CO2发生的反应为:Na2CO3+H2O+CO2=2NaHCO3,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以向饱和Na2CO3溶液中通入足量CO2会析出碳酸氢钠晶体,所以产生白色沉淀,故正确;
故选:C.
点评 本题考查物质之间的化学反应,熟悉复分解反应发生的条件及常见物质的溶解性是解答本题的关键,注意④根据物质的溶解度能判断产生沉淀,该题为易错选项.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:解答题
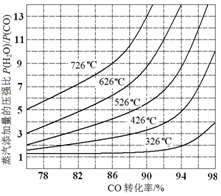 实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:
实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
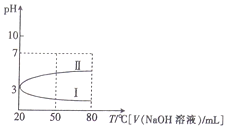
| A. | 0.1mol•L-1NH4Al(SO4)2溶液c(NH4+)大于等浓度的NH4HSO4溶液中c(NH4+) | |
| B. | 向100mL0.1mol•L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol•L-1NaOH 溶液时,溶液pH的变化如曲线II | |
| C. | 升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了NH4Al(SO4)2的电离 | |
| D. | 20℃时,0.1mol•L-1NH4Al(SO4)2溶液中:2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁俗名铁红,可用作红色涂料 | |
| B. | 氢氧化铝是两性氢氧化物,可用于治疗胃酸过多 | |
| C. | 铁是地壳中含量最多的金属元素 | |
| D. | 保存硫酸亚铁溶液常加铁粉防氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CCl4所含的分子数为0.5NA | |
| B. | 将含有0.1mol FeCl3的饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA | |
| C. | 1mol/L的氯化钠溶液中,所含离子数为NA | |
| D. | 常温下,CO和N2混合物共2.8g,所含有的原子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com