
某同学组装如图所示电化学装置,电极I为Zn,其它电极均为Cu.下列说法错误的是()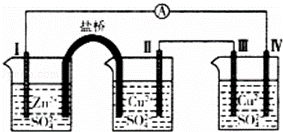
A. 电极I发生氧化反应
B. 相同的时间内,电极Ⅱ与Ⅳ质量变化相同
C. 电极Ⅲ的电极反应:4OH﹣﹣4e﹣=2H2O+O2↑
D. 电流方向:电极Ⅳ→ →电极I
→电极I
考点: 原电池和电解池的工作原理.
专题: 电化学专题.
分析: 电极Ⅰ为Zn,其它均为Cu,Zn易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,电子方向从负极流向正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,据此分析解答.
解答: 解:电极Ⅰ为Zn,其它均为Cu,Zn易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,
A.电极Ⅰ上电极上为Zn失电子,发生氧化反应,故A正确;
B、电极II是正极,电极反应:Cu 2++2e﹣=Cu;电极Ⅳ是阴极,该电极上发生反应为Cu 2++2e﹣=Cu,由于流经各个电极的电子的量相同,故两个电极的质量变化相同,故B正确;
C、电极Ⅲ为阳极,电极反应式为Cu﹣2e﹣═Cu2+,故C错误;
D、电子方向从负极流向正极,即电极Ⅰ→电极Ⅳ,而电流方向与电子的方向相反,故电流的流向为:电极Ⅳ→ →电极I,故D正确;
→电极I,故D正确;
故选C.
点评: 本题考查了原电池原理,正确判断正负极是解本题关键,再结合各个电极上发生的反应来分析解答,题目难度中等.


科目:高中化学 来源: 题型:
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.1mol/L FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是 、
(2)下列有关配制过程中说法错误的是 (填序号).
a.用电子天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90nL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色.某同学对产生黄色的原因提出了假设:
假设1:Br﹣被C12氧化成Br2溶解在溶液中; 假设2:Fe2+被C12氧化成Fe3+.
(1)请你完成表格,验证假设:
实验步骤、预期现象 结论
①溶液中加入适量四氯化碳 假设1正确
②向溶液中加入 假设2正确
若假设1正确,从实验①中分离出Br2的实验操作名称是 ;
(2)实验证明:还原性Fe2+>Br﹣,请用一个离子方程式来证明: ;
(3)若在50mL上述FeBr2溶液中通入5×10﹣3molCl2,反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 0.1 mol.L﹣1 NaOH溶液:K+、Na+、SO42﹣、CO32﹣
B. 0.1 mol•L﹣1 Na2CO3溶液:K+、Ba2+、NO3﹣、Cl﹣
C. 0.1 mol•L﹣1 FeCl3溶液:K+、NH4+、I﹣、SCN﹣
D. 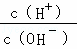 =1×l014的溶液:Ca2+、Na+、ClO﹣、NO3﹣
=1×l014的溶液:Ca2+、Na+、ClO﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是()
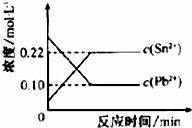
A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C. 升高温度,平衡体系中c(Pb2+)增大,说明该反应为吸热反应
D. 25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
强酸和强碱在稀溶液里反应的热化学方程式可表示为:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1已知:CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=﹣Q1 kJ•mol﹣1 HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=﹣Q2 kJ•mol﹣1上述均是在溶液中进行的反应,Q1、Q2的关系正确的是()
A. Q1=Q2=57.3 B. Q1>Q2>57.3 C. Q1<Q2=57.3 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断不正确的是(不计CO2溶解)()
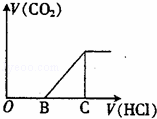
A. 若OB=0,则形成溶液M所发生反应的离子方程式为OH﹣+CO2═HCO3﹣
B. 若OB=BC,则溶液M为Na2CO3溶液
C. 若OB>BC,则溶液M中大量存在的阴离子为CO32﹣和HCO3﹣
D. 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
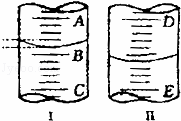
(如图)(1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是 mL.
(2)图Ⅱ表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) .
A.是a mL B.是(25﹣a)mLC.一定大于a mL D.一定大于(25﹣a)mL
(3)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7KJ/mol,
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=﹣534KJ/mol,
则肼与NO2完全反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
环扁桃醋具有松弛血管平滑肌,扩张血管的功能,其结构简式如图.下列对该物质叙述中,正确的是()
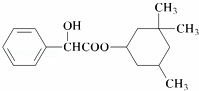
A. 该物质属于芳香烃
B. 该有机物难溶于水
C. 分子式为C17H23O3
D. 1 mol 该物质最多可与2 molNaOH发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com