
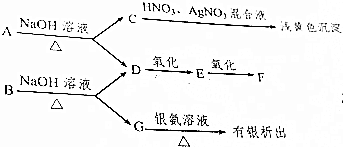
分析 D和F在浓硫酸作用下可生成分子式为C4H8O2的有机物H,可知D和F的反应为酯化反应,由转化关系可知D为CH3CH2OH,E应为CH3CHO,F为CH3COOH,H为CH3COOCH2CH3,A在氢氧化钠溶液中生成C和D,C与硝酸酸化的硝酸银反应生成浅黄色沉淀,则C为NaBr,可知A应为CH3CH2Br,B在氢氧化钠溶液中生成D和G,G可发生银镜反应,可知B应为酯,G为HCOONa,B应为HCOOCH2CH3,以此解答该题.
解答 解:D和F在浓硫酸作用下可生成分子式为C4H8O2的有机物H,可知D和F的反应为酯化反应,由转化关系可知D为CH3CH2OH,E应为CH3CHO,F为CH3COOH,H为CH3COOCH2CH3,A在氢氧化钠溶液中生成C和D,C与硝酸酸化的硝酸银反应生成浅黄色沉淀,则C为NaBr,可知A应为CH3CH2Br,B在氢氧化钠溶液中生成D和G,可知B应为酯,D为乙醇,则G为酸,且G发生银镜反应,则G为HCOONa,B应为HCOOCH2CH3,
故答案为:溴乙烷,甲酸乙酯,溴化钠,乙醇,乙醛,乙酸,甲酸钠.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析能力的考查,题目侧重官能团的考查,注意题给信息以及有机物的转化关系,可采用正逆推相结合的方法推断,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该烃能使溴水褪色 | B. | 该烃有三种不同的物质 | ||
| C. | 该烃的一氯取代物4种 | D. | 该烃的二氯取代物6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一种阳离子和一种阴离子 | B. | 一种单质分子和一种化合物分子 | ||
| C. | 两种原子 | D. | 一种原子和一种分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com