
| A. | 电解氯化镁溶液的阴极电极反应式:Mg2++2e-═Mg | |
| B. | 惰性电极电解饱和食盐水:2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| C. | 醋酸与乙醇混合、浓硫酸催化加热:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | 硫酸铝和小苏打溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
分析 A.阴极镁离子不放电,水电离的氢离子得到电子生成氢气;
B.电解饱和食盐水生成氢氧化钠、氢气和氯气;
C.醋酸与乙醇在浓硫酸存在条件下加热发生酯化反应生成乙酸乙酯和水;
D.小苏打为碳酸氢钠,碳酸氢根离子不能拆开.
解答 解:A.电解氯化镁溶液的阴极氢离子得到电子生成氢气,氢氧根离子与镁离子生成氢氧化镁沉淀,正确的电极反应式:Mg2++2H2O+2e-═H2↑2Mg(OH)2↓,故A错误;
B.惰性电极电解饱和食盐水,水不能拆开,正确的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,故B错误;
C.醋酸与乙醇混合、浓硫酸催化加热,反应的离子方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,故C正确;
D.硫酸铝和小苏打溶液混合,碳酸氢根离子不能拆开,正确的离子方程式为:Al3++3HCO3-═Al(OH)3↓+3CO2↑,故D错误;
故选C.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
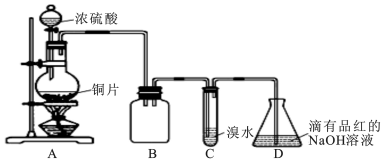
| 序号 | 实验操作 | 预期现象及结论 |
| ① | 取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡. | 若固体溶解,产生气泡,则Ⅰ或Ⅱ成立. |
| ② | 继续向试管A中滴加溴水,充分振荡. | 若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立 |
| ③ | 另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡. | 溶液变为蓝色,则Ⅲ成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
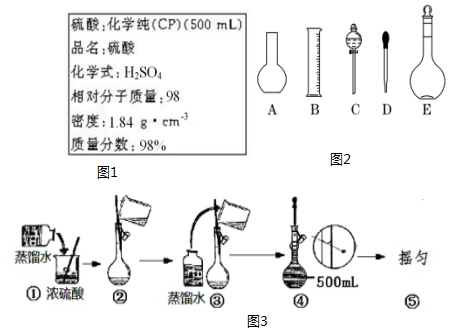
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
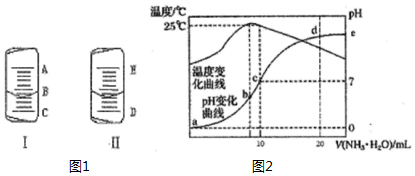 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.| 实验编号 | 待测CH3COOH溶液的体积/mL | NaOH溶液的体积/mL |
| 1 | 20.00 | 24.01 |
| 2 | 20.00 | 23.99 |
| 3 | 20.00 | 22.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 向豆浆中加入盐卤(主要成分为MgCl2)可制作豆腐,利用了胶体聚沉的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 冰镇的啤酒打开后泛起泡沫 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
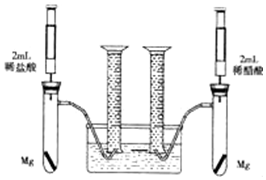 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入2molNH3反应达平衡时共吸收92.4kJ的热量 | |
| B. | 若转移1.5mol电子,则消耗0.75mol的H2 | |
| C. | 当V正(N2)=3V逆(H2)时,反应达到平衡 | |
| D. | 当反应达到平衡时,增大压强,V逆减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com