
����Ŀ��A��B��C��D���ֶ���������Ԫ�������ڱ��е����λ����ͼ��ʾ����֪A����������ϼۺ�������ϼ۴����͵���0���ش��������⣺

��1��Ԫ��E�����ڱ��е�λ����___��
��2��BD3���ӵĵ���ʽΪ___��
��3����Ԫ��B��C��D��E����̬�⻯���У��ȶ�����ǿ����___ (�ѧʽ)��
��4����Ƽ�ʵ��֤��Ԫ��D�ķǽ����Ա�Ԫ��C��ǿ��___��
��5��д��һ����������������A���⻯��Ľṹ��ʽ___ (�����������칹)��
�ٷ����к���6��Aԭ��
����ʹ��ˮ��ɫ
��һ�ȴ���ֻ��һ�ֽṹ
�ܲ�����
���𰸡��������ڢ�A�� ![]() HCl ��Na2S��Һ����H2S��Һ����ͨ��Cl2����μ���ˮ������������ɫ����
HCl ��Na2S��Һ����H2S��Һ����ͨ��Cl2����μ���ˮ������������ɫ���� 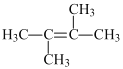
��������
A��B��C��D��Ϊ����������Ԫ�أ�A����������ϼۺ�������ϼ۴����͵���0����AӦΪ����A��Ԫ�أ���������Ԫ����Ԫ�����ڱ��е����λ�ÿ�֪AӦΪC��BΪP��CΪS��DΪCl��EΪBr��
(1)BrԪ��λ�ڵ���������A�壻
(2)BD3����ΪPCl3�����ԭ�Ӿ�����8�����ȶ��ṹ������ʽΪ![]() ��
��
(3)�ǽ���Խǿ������̬�⻯���ȶ���Խǿ��ͬ��������Ԫ�ش������ҷǽ�������ǿ��ͬ����Ԫ�����϶��·ǽ����Լ�������������Ԫ���зǽ�������ǿ��ΪCl�����⻯��ΪHCl��
(4)�ǽ�����Խǿ���䵥�ʵ�������Խǿ���ݴ˿������ʵ�飺��Na2S��Һ(��H2S��Һ)��ͨ��Cl2(��μ���ˮ)����������ɫ���ǣ�˵��Cl2��S2-������S����������Cl2>S��˵��Cl�ķǽ�����ǿ��S��
(5)A���⻯��Ϊ���࣬��ij���⻯�����㣺
�ٷ����к���6��Aԭ�ӣ�������6��Cԭ�ӣ�
����ʹ��ˮ��ɫ��˵������̼̼˫��������(�ӳ���ɫ)�����б���(��ȡ��ɫ)��
��һ�ȴ���ֻ��һ�ֽṹ�����÷��ӽṹ�߶ȶԳƣ�ֻ��һ�ֻ������⣻
�ܲ�������˵�����DZ���������������Ϊ�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ������̫���ܹ�������ѧ��Ϸֽ������о��л���½�չ�����װ����ͼ��ʾ������˵����ȷ����

A.��װ�ù���ʱ��H+��b��������a����
B.��������й�������ת��Ϊ��ѧ��
C.a���Ϸ����ĵ缫��ӦΪFe3++e-=Fe2+
D.a�����費�ϲ��京Fe3+��Fe2+����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.1000 mol��L1KMnO4������Һ�ζ�δ֪Ũ�ȵ���ɫH2C2O4��Һ����Ӧ���ӷ���ʽ�ǣ�2MnO4��5H2C2O4��6H+![]() 2Mn2+��10CO2����8H2O�����������⣺
2Mn2+��10CO2����8H2O�����������⣺
(1)�õζ�ʵ�����IJ���������______________��(����ĸ)
A����ʽ�ζ��� B����ʽ�ζ��� C����Ͳ D����ƿ
E������̨ F���ζ��ܼ� G����ֽ H��©��
(2)����________(����������������)ʽ�ζ���ʢ�Ÿ��������Һ���Է���ԭ��___________________��
(3)�ζ��յ������Ϊ_________________________________________________________��
(4)���ζ���ʼ�ͽ���ʱ���ζ����е�Һ����ͼ��ʾ������ʼ����Ϊ____mL���յ����Ϊ_____mL��

(5)ijѧ������3��ʵ��ֱ��¼�й��������±���
�ζ����� | ����H2C2O4��Һ�����/mL | 0.1000 mol/L KMnO4�����(mL) | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | 0.00 | 26.11 | 26.11 |
�ڶ��� | 25.00 | 1.56 | 30.30 | 28.74 |
������ | 25.00 | 0.22 | 26.31 | 26.09 |
�����ϱ�������ʽ�����H2C2O4��Һ�����ʵ���Ũ��Ϊ_______________��
(6)���в����п���ʹ�ⶨ���ƫ�͵���___________(����ĸ)��
A����ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע��KMnO4��Һ
B���ζ�ǰʢ�Ų�����Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ���������
D����ȡKMnO4��Һʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������������Ҫ�ɷ�ΪFeCO3������SiO2��Al2O3���������ʣ�Ϊԭ���Ʊ��Ȼ������壨FeCl3��6H2O����ʵ��������£�
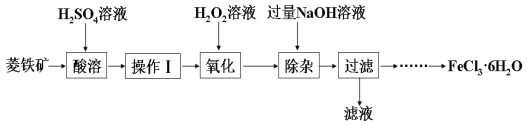
��1�����ܼ����������о��豣�����������Ŀ�ij��������Ԫ�صĽ�����֮�⣬����___________��
��2��������������___________��
��3���μ�H2O2��Һ����ʱ��������Ҫ��Ӧ�����ӷ���ʽΪ___________��
��4����֪�����軯�صĻ�ѧʽΪK3[Fe(CN)6]�������軯�صĻ�ѧʽΪK4[Fe(CN)6]��
3Fe2++2[Fe(CN)6]3=Fe3[Fe(CN)6]2��(��ɫ����)
4Fe3++3[Fe(CN)6]4=Fe4[Fe(CN)6]3��(��ɫ����)
ȷ��Fe2+�Ƿ�������ȫ�ķ�����___________��(����ѡ����Լ������軯����Һ�������軯����Һ�����ۡ�KSCN��Һ)
��5���������NaOH��Һ��Ŀ����___________��
��6���벹�������ɹ��˺�õ��Ĺ����Ʊ�FeCl3��6H2O��ʵ�鷽��������˺����ù��壬��ˮϴ�ӹ���2-3�Σ����¸���õ�FeCl3��6H2O��___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п�̵�ص��ܷ�ӦΪZn+2MnO2+2H2O=2MnOOH+Zn(OH)2�������й�˵��������ǣ� ��
A.пΪ��������
B.�õ������Һ������ϡ����
C.������ӦʽΪMnO2+H2O+e-=MnOOH+OH-
D.����13gпʱ��·��ת�Ƶ��ӵ����ʵ���Ϊ0.4mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ ����������
����������![]() ��
��![]() �ζ�
�ζ�![]() ijһԪ��
ijһԪ��![]() �Ľ����ͼ��ʾ������˵������ȷ����
�Ľ����ͼ��ʾ������˵������ȷ����

A. ![]() ��������
��������
B. ���������У�![]() ��ʱˮ�ĵ���̶����
��ʱˮ�ĵ���̶����
C. ![]() ���ӦҺ��
���ӦҺ��![]()
D. ![]() ��������Ϊ
��������Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ຬ�Ȼ�������������������Ӧ�÷dz��㷺�����ʡ������ȣ�SO2Cl2����ʵ�����г����Լ�����֪��SO2Cl2��g��![]() SO2��g����Cl2��g��
SO2��g����Cl2��g��
��1����2 L�����ܱ���ʴ�Ե������г���0��1 mol SO2Cl2��g��������Ӧ����101 kPa��375K�����½��и÷�Ӧ��SO2Cl2��ת������ʱ���ϵ��ͼ��ʾ��
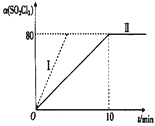
��ƽ��ʱ��������ѹǿp��_________________��
��������ߢ��Ӧʵ�飬���ı�һ�������õ�����I������I�ı������������_____________________��
��2��һ���������ñ��ʹ�����Һ����ǡ��ֻ���������Σ����������壩������Һ��������Ũ�ȴ�С˳��Ϊ______________________________________________________��
��3����֪�������£������ᣨHClO���ĵ��볣��Ka��2��5��10��8�����ڸ��¶��£�NaClOˮ�ⷴӦ��ˮ�ⳣ��KhΪ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ��pH(���������£���֪lg2=0.3��lg5=0.7��lg5.5=0.74)
(1)0.0005mol/L��������ҺpH=________.(2)0.0005mol/L������������ҺpH=_________.
(3)��10ml,pH=12������������ˮϡ�͵�1LpH=______________.
(4)��pH=1�������pH=4�������������pH=_______________.
(5)��pH=1������aL��pH=11����������bL��Һ��ϣ������ҺΪ���ԣ���a��b=_______.
(6)��pH=3��pH=4��ϡ�����������ʱ����Ϻ���Һ��pH=_________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ�������ʵ�ı�����ȷ����
A. ������룺CH3COOH==CH3COO+ H+
B. Na2O2��CO2��Ӧ�ṩO2��Na2O2 +CO2==Na2CO3 + O2
C. NO2��ˮ��Ӧ�����NO2 +H2O==H++ NO3
D. NaOH��Һ��ȥ�����������Ĥ��Al2O3+2OH==2AlO2+H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com