
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
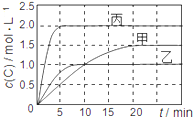
容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度 | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是 ( )
A. 由图可知:T1<T2,且该反应为吸热反应
B. T1时该反应的平衡常数K=7.2
C. 前10min甲、乙、丙三个容器中A的平均反应速率:v(A)乙<v(A)甲<v(A)丙
D. 平衡时A的质量m:m乙<m甲<m丙
【答案】B
【解析】图象分析可知乙,丙相同温度下进行反应,相当于丙比乙的起始量增大一倍,图象中达到平衡状态时,C的浓度并丙中为乙中的2倍,说明容器内是浓度增大一倍,平衡未动,x值为1
A、先拐先平,温度高,比较甲和乙可知,相同条件下乙先达到平衡状态,T2>T1,温度越高,C的浓度越小,说明升温平衡逆向进行,正反应为放热反应,A错误;B、T1时的反应结合三段式列式计算平衡浓度
A(g)+B(g)2C(g)
起始量(mol/L) 1 2 0
变化量(mol/L) 0.75 0.75 1.5
平衡量(mol/L) 0.25 1.25 1.5
K=1.52/0.25×1.25=7.2,B正确;C、前10min,乙和丙温度相同,丙达到平衡时间短,反应速率大,甲和乙在前10minC的浓度增大相同,所以C的反应速率相同;速率之比等于化学方程式的计量数之比,甲和乙速率相同,乙此时达到平衡,甲为达到平衡,C错误;D、图象可知甲乙起始量相同,达到平衡状态,生成C的浓度不同,甲中为1.5mol/L,乙中为1.0mol/L,则A的质量乙中比甲中大,D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应3Cl2 + 6NaOH=5NaCl + NaClO3 + 3H2O,对该反应的下列说法不正确的( )
A. Cl2既是氧化剂,又是还原剂
B. 反应中转移的电子数为5e-
C. 氧化剂与还原剂的质量比是1∶5
D. 被氧化的氯原子数与被还原的氯原子数之比是1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蜜蜂信息素的成分之一是乙酸异戊酯,它具有香蕉的香味,实验室用乙酸和异戊醇[(CH3)2CHCH2CH2OH]制备乙酸异戊酯的反应、装置示意图和有关数据如下:
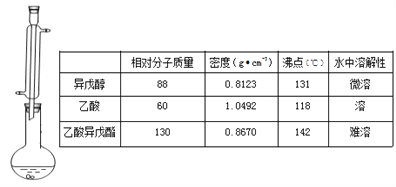
实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和23片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物中加入少量无水MgSO4固体,静置片刻,过滤除去MgS04固体,进行蒸馏纯化,收集140143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)装置B的名称是 ___________,作用是______________。
(2)碎瓷片的作用是______________ 。
(3)欲得到乙酸异戊酯,在洗涤、分液操作中,应充分振荡,然后静置,待分层后__________
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)实验中加入少量无水MgS04的目的是____________ 。
(5)A中的反应方程式为___________________,本实验的产率是____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com