
| A. | 热稳定性:H2O>HF>H2S | |
| B. | NH4Cl的电子式: | |
| C. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| D. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
分析 A、元素的非金属性越强,对应的氢化物越稳定;
B、电子式需要把各微粒中最外层电子标出,氯离子最外层电子数未标出;
C、依据反应能否自发进行的判据解答,:△H-T△S<0反应自发进行;
D、减少生成物的浓度,反应速率减小.
解答 解:A、非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,所以稳定性:HF>H2O>H2S,故A错误;
B、氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,故B错误;
,故B错误;
C、反应能自发进行说明:△H-T△S<0,由方程式NH3(g)+HCl(g)═NH4Cl(s)可知该反应的<0,要使:△H-T△S<0,所以必须满足△H<0,故C正确;
D、减少生成物的浓度,反应速率减小,则合成氨生产过程中将NH3液化分离,减小正反应速率,平衡正移,提高N2、H2的转化率,故D错误;
故选C.
点评 本题考查了氢化物稳定性分析,电子式书写判断,反应自发进行的判断依据,反应速率影响元素等知识点,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
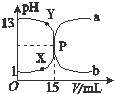 如图曲线a和b是盐酸与氧氧化钠溶液在常温下的相互滴定的滴定曲线,下列叙述中正确的是( )
如图曲线a和b是盐酸与氧氧化钠溶液在常温下的相互滴定的滴定曲线,下列叙述中正确的是( )| A. | 盐酸的物质的量浓度为1 mol•L-1 | |
| B. | P点时反应恰好完成,溶液呈中性,但它不是滴定终点 | |
| C. | X点时c(Cl-)>c(H+)>c(Na+)>c(OH-) | |
| D. | Y点时溶液呈碱性,溶液中c(H+)•c(OH-)>1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;A与C组成的化合物电子式为
;A与C组成的化合物电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子学说 | B. | 分子学说 | C. | 等电子体学说 | D. | 元素周期律 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com