
| A. | 摩尔质量:g/mol | B. | 气体摩尔体积:mol/L | ||
| C. | 溶解度:g/100gH2O | D. | 密度:g/cm3 |
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
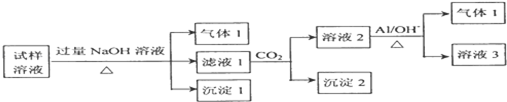
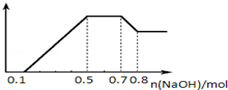
科目:高中化学 来源: 题型:解答题
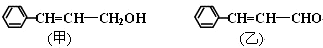
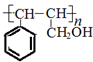 .
.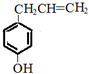 .
.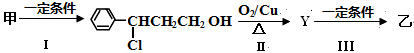
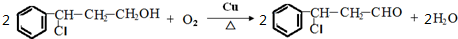 .
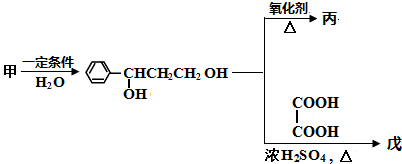
.
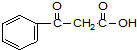 .
.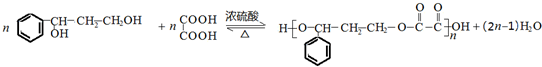 ;若戊为环状化合物,其结构简式是
;若戊为环状化合物,其结构简式是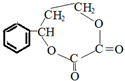 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
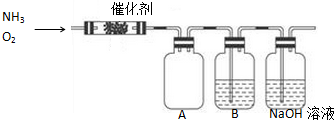
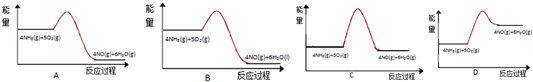
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铝是应用最广泛的两种金属.完成下列填空:
铁、铝是应用最广泛的两种金属.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
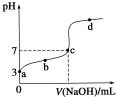 常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3mol/L | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | 滴定过程中溶液中的n (CH3COO-)+n(CH3COOH)的和不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的低价氧化物、Z的单质水溶液均具有漂白性,且与O3漂白的原理相同 | |
| B. | X与Z形成的化合物和W2Y的晶体类型相同 | |
| C. | 工业上常用电解相应的盐溶液制备W、X、Z的单质 | |
| D. | X元素的盐溶液可能呈酸性,也可能呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaClO溶液通入少量SO2气体:3ClO-+SO2+H2O=SO${\;}_{4}^{2-}$+Cl-+2HCl | |
| B. | 将过量的Cl2通入FeBr2中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | |
| C. | 向碳酸氢钙溶液滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至沉淀量最大:NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com