
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 60g丙醇中存在的共价键总数为10NA
B. 1L 0.1 mol·L-1的NaHCO3溶液中HCO3-和CO32-的离子数之和为0.1NA
C. 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1 NA
D. 235g核素![]() 发生裂变反应:
发生裂变反应:![]() +
+![]() +
+![]() +10
+10![]() ,净产生的中子(
,净产生的中子(![]() )数为10 NA
)数为10 NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知下列十种物质:
①H2O ②Cu ③NO ④SiO2 ⑤稀硫酸 ⑥氢氧化钡 ⑦饱和FeCl3溶液 ⑧氨水 ⑨稀硝酸 ⑩硫酸铝
根据上述提供的物质,回答下列问题:
(1)属于纯净物的是__________,属于电解质的是__________。(填数字序号)
(2)发生中和反应的离子方程式为H++OH-===H2O,该离子反应对应的化学方程式有__________________________________。
(3)实验室制备少量Fe(OH)3胶体所用到的物质有________(填数字序号),发生反应的离子方程式为_________________________。
(4)实验室配制0.5 mol·L-1 245 mL⑩的溶液,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管、________,需要用托盘天平称取溶质的质量为________g,从配制好的溶液中取出100 mL,其中含有的SO42—数目为________(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为_________________________。
②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。 为测定某碱式氯化铜的组成, 进行下列实验:
①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A;
②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 1722 g;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1。
CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
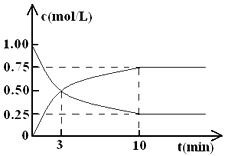
(1)从反应开始到平衡,氢气的平均反应速率v( H2 )= ________ ,CO2的转化率=________。
(2)该反应的平衡常数表达式k=__________ 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是_________________ (填编号)。
A.将H2O(g)从体系中分离B.充入He(g),使体系压强增大
C.升高温度 D.再充入lmolCO2和3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 石油裂解是为了获得更多汽油,以满足迅速增长的汽车需要
B. 1mol冰醋酸和1mol乙醇反应生成的水分子数目为NA
C. 沸点:汽油<煤油<柴油<润滑油
D. 乙酸分子中不含醛基,所以不能与新制的Cu(OH)2悬浊液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72 L CH4 ②3.01×1023个HCl ③13.6 g H2S ④0.2 mol NH3,下列对四种气体的关系表示不正确的是
A. 体积④<①<③<② B. 密度①<④<③<②
C. 质量④<①<③<② D. 氢原子数④<②<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
(1)M在元素周期表中的位置是__________________________。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________。
(3)由X、Y、Z三种元素可组成摩尔质量为84g·mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_____________________。
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为________。
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法中正确的是( )
A. 元素排序的依据是元素的相对原子质量
B. 元素排序的依据是原子的核电荷数
C. 同一横行或同一纵行元素的性质相同
D. 具有稳定的形式,不可能再有任何新的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com