
| A. | 0.005 | B. | 0.01 | C. | 0.002 | D. | 0.05 |
分析 0.01mol•L-1的H2SO4溶液中氢离子浓度为0.02mol/L,溶液在稀释前后溶质的物质的量不变,据此可知稀释后溶液中氢离子浓度为0.01mol/L;对于稀释后的溶液取出10mL,浓度与稀释后溶液的浓度相同.
解答 解:设稀释到1000mL时溶液中氢离子的浓度为x,
根据溶液在稀前后溶质的物质的量不变,
则0.01mol•L-1×2×0.5L=x×1L,
解得:x=0.01mol/L,
取出10mL溶液的浓度与稀释后溶液的浓度相同,则稀释后氢离子浓度为c(H+)=0.01mol/L,
故选B.
点评 本题考查物质的量浓度的有关计算,题目难度不大,明确稀释前后溶质的物质的量不变时解答本题的关键,并能利用物质的构成来分析离子的浓度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ③④⑤ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1<Q2 | |
| B. | △H1能表示单质碳的标准燃烧热 | |
| C. | 生成物总能量均低于反应物总能量 | |
| D. | 1molCO2气体具有的能量大于1mol干冰具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
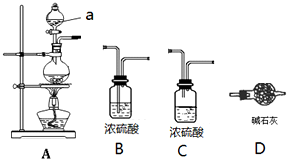
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.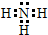 ,空间构型为三角锥形.
,空间构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
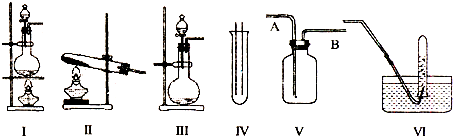
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;V\;}}{\;}$Fe(OH)3↓+3H+ | |
| C. | 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$\stackrel{盐酸}{→}$FeCl3$\stackrel{Fe}{→}$FeCl2 | |
| B. | Al(OH)3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| C. | NH4Cl(s)$→_{△}^{Ca(OH)_{2}(s)}$NH3$\stackrel{MgCl(aq)}{→}$Mg(OH)2) | |
| D. | C6H5ONa$\stackrel{盐酸}{→}$C6H5OH$\stackrel{Na_{2}CO_{3}(aq)}{→}$CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com