
分析 甲、乙、丙是分别由H、C、O、Si、Al、Cu等六种元素中的两种或多种元素组成的化合物.
含化合物甲的矿物是工业上电解法冶炼某种常见金属单质的原料,经检测甲是一种高熔点化合物,能溶于强酸、强碱溶液,结合物质含有的元素,甲为Al2O3;
化合物乙是光导纤维的主要成分,乙为SiO2;
化合物丙为一种呈深蓝色的盐,将一定量的丙隔绝空气加热分解生成一种黑色固体纯净物X、无色无味酸性气体Y,结合物质含有的元素,故Y为CO2或者CO2和H2O,固体X为CuO,即丙为碳酸铜或者碱式碳酸铜,据此分析解答.
解答 解:(1)由上述分析可知,Y为CO2,分子中碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,化合物乙为SiO2,属于原子晶体;
故答案为:O=C=O;原子晶体;
(2)甲为Al2O3,Al2O3与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
工业上常用Al2O3与焦炭、氯气共热生成化合物丁和CO,而丁仅由两种元素组成,由元素守恒可知丁为AlCl3,又1g焦炭完全反应生成气态丁放出a kJ的热量,属于反应的热化学方程式为Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H=-36 kJ•mol-1;
故答案为:Al2O3+2OH-=2AlO2-+H2O;Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H=-36 kJ•mol-1;
(3)由上述分析可知,化合物丙可能为碳酸铜或者碱式碳酸铜,将少量固体丙于试管中加热(试管中黑色固体产生),将生成的气体依次通过装有无水硫酸铜和澄清石灰水的装置,如无水硫酸铜变蓝色,澄清石灰水变浑浊,则假设B成立,
故答案为:①碱式碳酸铜;②将少量固体丙于试管中加热(试管中黑色固体产生),将生成的气体依次通过装有无水硫酸铜和澄清石灰水的装置,如无水硫酸铜变蓝色,澄清石灰水变浑浊,则假设B成立.
点评 本题是物质推断题,涉及元素单质及化合物性质推断及其实验的设计,难度较大,是对所学知识的综合运用,旨在考查学生的推理思维能力.


科目:高中化学 来源: 题型:解答题
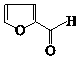 ).通常条件下,糠醛是无色油状液体,在空气中易变成黄棕色,能溶于丙酮、苯、乙醚等有机溶剂中,能与水部分互溶.糠醛用途广泛,如:用糠醛替代甲醛与苯酚在酸或碱催化下合成的酚醛树脂,可用作砂轮、砂纸、砂布的黏合剂;糠醛的氧化产物己二酸是合成锦纶纤维的重要单体;糠醛在以CuO-Cr2O3作为催化剂并加热加压的条件下,可制得糠醇(
).通常条件下,糠醛是无色油状液体,在空气中易变成黄棕色,能溶于丙酮、苯、乙醚等有机溶剂中,能与水部分互溶.糠醛用途广泛,如:用糠醛替代甲醛与苯酚在酸或碱催化下合成的酚醛树脂,可用作砂轮、砂纸、砂布的黏合剂;糠醛的氧化产物己二酸是合成锦纶纤维的重要单体;糠醛在以CuO-Cr2O3作为催化剂并加热加压的条件下,可制得糠醇(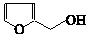 ),糠醇可以合成多种树脂;此外,糠醛还是合成香料、药物、染料等的原料.
),糠醇可以合成多种树脂;此外,糠醛还是合成香料、药物、染料等的原料.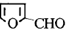 +H2$→_{加热加压}^{CuO-Cr_{2}O_{3}}$
+H2$→_{加热加压}^{CuO-Cr_{2}O_{3}}$ .
.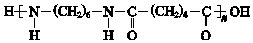
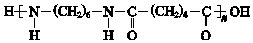 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )| A. | 该电池工作时电能转化为化学能 | |
| B. | 有1mol电子转移时,反应的氧气为5.6L | |
| C. | 外电路中电流由电极b通过导线流向电极a | |
| D. | 电极b的反应为:O2+4e-+H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加).下列判断错误的是( )
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加).下列判断错误的是( )| A. | 由图中信息可知,HA一定是强酸 | |
| B. | 当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol•L-1 | |
| C. | N点对应的溶液中c(M+)=c(A-) | |
| D. | K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| I | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| II | 探究温度对降解速率的影响 | ① | ② | ③ | ④ |
| III | ⑤ | 298 | 10 | 6.0 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A. | 苛性钾溶液中KOH的质量是16.8 | |
| B. | 反应中转移电子0.21mol | |
| C. | 氯气被还原成0.06molClO-和0.03molClO3- | |
| D. | ClO3-的生成是由于温度升高引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2⑩Cu+HNO3;在不同条件下得到不同产物的是( )
⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2⑩Cu+HNO3;在不同条件下得到不同产物的是( )| A. | 除⑤ | B. | 除②⑤ | C. | 除④⑥ | D. | 除④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | (CH3)2CHOH | ||
| C. | CH3CH2C(CH3)2CH2OH | D. | CH3CH2C(CH3)2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com