
| A. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| B. | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 | |
| D. | 称取3.80g固体,加热至恒重,质量减少了0.620g.用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |
分析 A.Na2CO3、NaCl均与AgNO3溶液反应生成白色沉淀;
B.加CaO,均与Na2CO3、NaHCO3反应生成白色沉淀;
C.向溶液中通入足量的CO2,观察到有晶体析出,一定发生Na2CO3+CO2+H2O=2NaHCO3;
D.由2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O可知,结合固体差量可知n(CO2)=$\frac{0.62g}{62g/mol}$=0.01mol,则原混合物中含碳酸氢钠为0.02mol,且生成碳酸钠为0.01mol,用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,n(CO2)=$\frac{0.88g}{44g/mol}$=0.02mol,则原混合物中含碳酸钠为0.01mol,二者质量为106g/mol×0.01mol+84g/mol×0.02mol=27.4g.
解答 解:A.Na2CO3、NaCl均与AgNO3溶液反应生成白色沉淀,则有白色沉淀生成,不能说明原固体中一定含有NaCl,故A错误;
B.加CaO,均与Na2CO3、NaHCO3反应生成白色沉淀,则有白色沉淀生成,不能说明原固体中一定含有Na2CO3,故B错误;
C.向溶液中通入足量的CO2,观察到有晶体析出,一定发生Na2CO3+CO2+H2O=2NaHCO3,则有晶体析出,说明原固体中一定含有Na2CO3,故C正确;
D.称取3.80g固体,加热至恒重,质量减少了0.620g,则
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
168 106 1 62
n 0.62g
结合固体差量可知n(CO2)=$\frac{0.62g}{62g/mol}$=0.01mol,则原混合物中含碳酸氢钠为0.02mol,且生成碳酸钠为0.01mol,用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,n(CO2)=$\frac{0.88g}{44g/mol}$=0.02mol,则原混合物中含碳酸钠为0.01mol,二者质量为106g/mol×0.01mol+84g/mol×0.02mol=27.4g,则原固体中含有Na2CO3和NaHCO3、NaCl,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、差量法计算、原子守恒等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合及实验评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
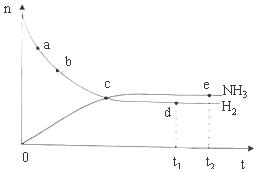 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2(NaOH) | B. | SnCl2(HCl) | C. | FeCl3(HCl) | D. | FeSO4(Fe) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2O2和H2O 反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 用氢氧化钠溶液除去金属铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 用食醋除去水瓶中的水垢:2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O | |
| D. | 等体积、等浓度的Ba(OH)2浓溶液和NH4HCO3 浓溶液混合后并加热Ba2++OH-+HCO3-═BaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和NaHCO3粉末与同浓度盐酸反应,Na2CO3碱性强,反应放出气体速度快 | |
| B. | 等物质的量的两种盐与同浓度的盐酸反应,Na2CO3消耗盐酸的体积是NaHCO3的两倍 | |
| C. | 向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出 | |
| D. | Na2CO3和NaHCO3溶液分别和BaCl2溶液反应,现象不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2完全转化为SO3 | |
| B. | SO2、O2与SO3的物质的量之比为2:1:2 | |
| C. | 反应混合物中,SO3的质量分数不再改变 | |
| D. | 消耗2 mol SO2的同时生成2 mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
. 与Br2,要想得到纯净的该产物,可用NaOH溶液(或水)洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的该产物,可用NaOH溶液(或水)洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①②④ | C. | ①③⑤ | D. | ①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com