
| A. | TNT的制备: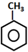 +3HNO3$→_{100℃}^{浓硫酸}$ +3HNO3$→_{100℃}^{浓硫酸}$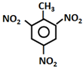 +3H2O +3H2O | |
| B. | 溴乙烷的消去反应:C2H3Br+NaOH$→_{△}^{水}$C2H4↑+NaBr+H2O | |
| C. | 乙醇氧化成乙醛:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O | |
| D. | 乙酸乙酯在碱性条件下水解:CH3COOC2H5+H2O$?_{△}^{碱性}$CH3C0OH+C2H5OH |
分析 A.甲苯与浓硝酸发生取代反应可生成TNT,即三硝基甲苯,三硝基甲苯不存在碳氧键,结构简式错误;
B.溴乙烷在氢氧化钠的醇溶液中发生消去反应,消去反应条件错误;
C.乙醇在铜或银催化作用下加热生成乙醛;
D.乙酸乙酯在碱性条件下完全水解,水解生成乙酸钠和乙醇.
解答 解:A.三硝基甲苯不存在碳氧键,结构简式错误,甲苯可以和浓硝酸之间发生取代反应生成2,4,6-三硝基甲苯,即TNT,化学反应方程式为 ,故A错误;
,故A错误;
B.溴乙烷与氢氧化钠的醇溶液共热发生消去反应,生成乙烯和溴化钠,水;反应的化学方程式为:CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O,故B错误;
C.乙醇中含-OH,能发生催化氧化生成乙醛,该反应方程式为:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O,故C正确;
D.乙酸乙酯在碱性条件下的水解方程式是:CH3COOC2H5+NaOH→CH3COONa+C2H5OH,故D错误;
故选C.
点评 本题考查了有机化学反应方程式的书写,注意掌握相关官能团的性质以及有机化合物的断键部位,注意发生的反应类型,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CF4、CCl4、CBr4、CI4的熔点沸点升高与范德华力有关 | |
| B. | H2O的熔、沸点大于H2S的是由于H2O之间存在氢键 | |
| C. | 乙醇与水互溶可以用相似相溶原理解释 | |
| D. | 分子晶体中分子一定紧密堆积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该病毒主要通过血液向他人传染 | |
| B. | 该病毒在浓盐溶液中一定会发生变性 | |
| C. | 通常将病毒样本保存在福尔马林中 | |
| D. | 该病毒在一定条件下水解最终会生成氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、油脂、天然橡胶和蛋白质分子中均含有双键 | |
| B. | 相同物质的量的甲基、羟基或氨基所含的电子数目相同 | |
| C. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数不为定值 | |
| D. | 利用红外光谱仪记录的红外光谱图可以初步推测有机化合物中官能团的类别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液 | CH3COONa | Na2CO3 | Na2CO3 | HClO | C6H5ONa |
| PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H>0 | |
| D. | SO2与SiO2的晶体中,化学键种类和晶体类型均相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com