
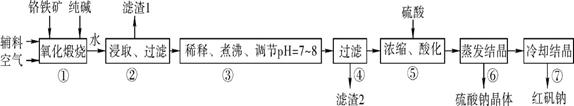
分析 铬铁矿(主要成分为FeO•Cr2O3,还含有Al2O3、SiO2等杂质)加入碳酸钠煅烧,可生成Na2CrO4、Fe2O3、NaAlO2、Na2SiO3等,加入水浸取,得到滤渣1为Fe2O3,过滤后将滤液稀释、煮沸、调节pH7~8得到滤渣2为Al(OH)3、H2SiO3,过滤后将滤液酸化,发生了反应2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O,生成了Na2Cr2O7和Na2SO4,蒸发结晶得到硫酸钠,冷却结晶得到Na2Cr2O7•2H2O,
(1)①中反应是在回转窑中进行的,反应时需不断搅拌,可增大反应物的接触面积;
(2)杂质Al2O3在①中转化生成NaAlO2;
(3)滤液中含有NaAlO2、Na2SiO3等,都为强碱弱酸盐,加热煮沸,促进水解,若调节pH过低,H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+与Na2CrO4难以分离;
(4)酸化使CrO42-转化为Cr2O72-,反应的离子方程式为2CrO42-+2H+?Cr2O72-+H2O;
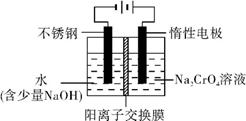
(5)阴极上氢离子放电生成氢气,阳极上氢氧根放电生成氧气.
解答 解:铬铁矿(主要成分为FeO•Cr2O3,还含有Al2O3、SiO2等杂质)加入碳酸钠煅烧,可生成Na2CrO4、Fe2O3、NaAlO2、Na2SiO3等,加入水浸取,得到滤渣1为Fe2O3,过滤后将滤液稀释、煮沸、调节pH7~8得到滤渣2为Al(OH)3、H2SiO3,过滤后将滤液酸化,发生了反应2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O,生成了Na2Cr2O7和Na2SO4,蒸发结晶得到硫酸钠,冷却结晶得到Na2Cr2O7•2H2O,
(1)①中反应是在回转窑中进行的,反应时需不断搅拌,可增大反应物的接触面积,加快反应速率,故答案为:增大反应物的接触面积,加快反应速率;
(2)杂质Al2O3在①中转化的化学反应方程式为Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑,故答案为:Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑;
(3)滤液中含有NaAlO2、Na2SiO3等,都为强碱弱酸盐,加热煮沸,促进水解平衡AlO2-+2H2O?Al(OH)3+OH-、SiO32-+2H2O?H2SiO3+2OH-向右移动,生成氢氧化铝、硅酸沉淀,若调节pH过低,H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+与Na2CrO4难以分离,
故答案为:水解吸热,煮沸促进水解平衡AlO2-+2H2O?Al(OH)3+OH-、SiO32-+2H2O?H2SiO3+2OH-向右移动,生成氢氧化铝、硅酸沉淀; H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+与Na2CrO4难以分离;
(4)酸化使CrO42-转化为Cr2O72-,反应的离子方程式为2CrO42-+2H+?Cr2O72-+H2O,故答案为:2CrO42-+2H+?Cr2O72-+H2O;
(5)溶液中有四种离子,重铬酸酸根,钠离子,氢离子和氢氧根,在阴极上氢离子放电:2 H++2e═H2↑或4H2O+4e-=OH-+2H2↑,在阳极上氢氧根放电:4OH--4e-═O2↑+2H2O,
故答案为:4H2O+4e-=OH-+2H2↑;4OH--4e-=2↑+2H2O.
点评 本题考查了物质制备流程和方案的分析判断,物质性质的应用,为高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.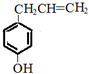 .
.
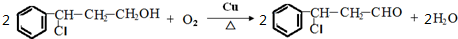 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
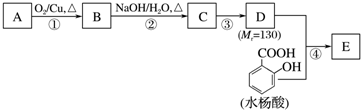
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

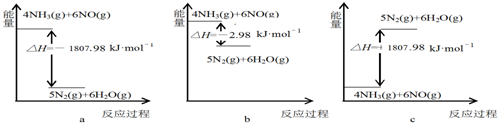
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属单质中一定存在共价键 | |
| B. | 含共价键的化合物一定是共价化合物 | |
| C. | 含离子键的化合物一定是离子化合物 | |
| D. | 溶于水能导电的化合物就是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能小于O原子 | 同周期元素原子的电离能随原子序数增大而增大 |
| B | CO2为直线形分子 | CO2分子中C为sp杂化,键角为180° |
| C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
| D | HF的沸点低于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既能与酸反应,又能与碱反应 | |
| B. | 导电性好 | |
| C. | 熔点低 | |
| D. | 具有还原性,在冶炼反应中放出大量的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:| 元素 | 相关信息 |
| Q | Q的单质是实验室常用的惰性电极材料 |
| R | R原子基态时2p原子轨道上有3个未成对电子 |
| T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
| X | X是第三周期电负性最大的元素 |
| Y | 元素Y位于周期表第10列 |
| Z | Z存在质量数为65,中子数为36的核素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com