
科目:高中化学 来源: 题型:
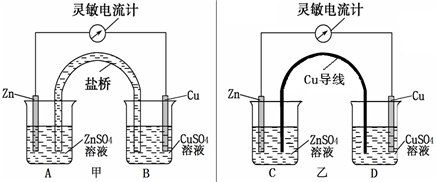
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省焦作市高二第一学期期末考试化学试卷(带解析) 题型:填空题
(14分)请根据所学的电化学原理,解决以下问题。
(1)依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s) 设计的双液原电池,可以提供稳定的电流。装置如图所示,其中盐桥中装有琼脂—饱和KCl溶液。
回答下列问题:
①电极X的材料和电解质溶液Y分别为 ;
②盐桥中K+移向 (填A或B);
③银电极发生的电极反应为 。
(2)下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液, (填X或Y)电极附近先变红色, X极上的电极反应式为 。
②若要在铁制品上镀一定厚度的Cu层,Y电极反应式为
③若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g。该金属的相对原子质量是 ;
查看答案和解析>>
科目:高中化学 来源:2013届河南省焦作市高二第一学期期末考试化学试卷(解析版) 题型:填空题
(14分)请根据所学的电化学原理,解决以下问题。
(1)依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s) 设计的双液原电池,可以提供稳定的电流。装置如图所示,其中盐桥中装有琼脂—饱和KCl溶液。
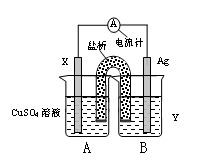
回答下列问题:
① 电极X的材料和电解质溶液Y分别为 ;
② 盐桥中K+移向 (填A或B);
③ 银电极发生的电极反应为 。
(2)下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
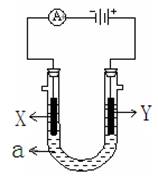
①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液, (填X或Y)电极附近先变红色, X极上的电极反应式为 。
② 若要在铁制品上镀一定厚度的Cu层,Y电极反应式为
③ 若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g。该金属的相对原子质量是 ;
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省无锡一中高二(下)期中化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com