
| A. | c(SO2)=0.1mol/L | B. | c(O2)=0.05mol/L | C. | c(SO3)=0.5mol/L | D. | c(SO2)=0.4mol/L |
分析 化学平衡研究的对象为可逆反应,化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:该题2SO2(g)+O2(g)?2SO3(g)是一个可逆反应.假设SO2(g)和O2(g)全部转化为SO3(g),
2SO2(g)+O2(g)?2SO3(g)
初始 0.2mol?L-1 0.15mol?L-1 0.2mol?L-1
变化 0.2mol?L-1 0.1mol?L-1 0.2mol?L-1
终了 0 0.05mol?L-1 0.4mol?L-1
假设SO3(g)全部转化为SO2(g)和O2(g)
2SO2(g)+O2(g)?2SO3(g)
初始 0.2mol?L-1 0.15mol?L-1 0.2mol?L-1
变化 0.2mol?L-1 0.1mol?L-1 0.2mol?L-1
终了 0.4mol?L-1 0.25mol?L-1 0
该反应是一个可逆反应,无论向正反应方向进行还是向逆反应方向进行,实际不可能100%转化,
根据分析可知:0<c(SO2)<0.4mol?L-1 ,0.05mol?L-1<c(O2)<0.25mol?L-1 ,0<c(SO3)<0.4mol?L-1 ,
A.c(SO2)=0.1mol/L满足0<c(SO2)<0.4mol?L-,符合条件,故A正确;
B.c(O2)=0.05mol/L不在范围内,不符合条件,故B错误;
C.c(SO3)=0.5mol/L不在范围内,不符合条件,故C错误;
D.c(SO2)=0.4mol/L不在范围内,不符合条件,故D错误;
故选A.
点评 本题考查可逆反应特点,题目难度不大,利用极限转化的思想来分析物质的最大浓度,但实际浓度一定小于最大浓度,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丙醇和2-甲基丁醇 | B. | 邻氯甲苯和对氯甲苯 | ||
| C. | 2-甲基丁烷和戊烷 | D. | 乙酸乙酯和丙酸丙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
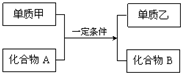 置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
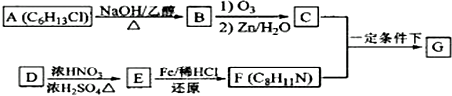


 +HO-NO2$→_{△}^{浓H_{2}SO_{4}}$
+HO-NO2$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).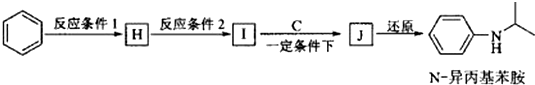
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 羟氨苄青霉素在空气中不能很稳定地存在 | |
| B. | 每个羟氨苄青霉素分子中含有3个手性碳原子 | |
| C. | 羟氨苄青霉素既能与盐酸反应,又能与碳酸氢钠溶液反应 | |
| D. | 羟氨苄青霉素可以与FeCl3发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com