
 ,根据官能团的不同可分为( )
,根据官能团的不同可分为( )| A. | 7类 | B. | 6类 | C. | 5类 | D. | 4类 |
分析 ①根据官能团为碳碳双键的烃分析;
②根据官能团为羧基分析;
③根据链烃基与羟基相连分析;
④根据官能团为溴原子判断;
⑤根据官能团为氯原子分析;
⑥根据分子中含有酯基判断;
⑦根据分子中含有酯基分析;
⑧根据羟基直接与苯环相连的结构判断.
解答 解:①CH2═CH2,含有碳碳双键的烃,属于烯烃;
②CH3CH2COOH,分子中含有官能团羧基,属于羧酸;
③C2H5OH,羟基与链烃基相连,属于醇类;
④CH3CH2Br,官能团-Br与烃基相连,属于卤代烃;
⑤CCl4,官能团为-Cl,属于卤代烃;
⑥CH3COOCH3,含有官能团酯基,属于酯类;
⑦CH3COOC2H5,官能团为酯基,属于酯类;
⑧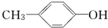 ,官能团羟基与苯环直接相连,属于酚类;
,官能团羟基与苯环直接相连,属于酚类;
所以据官能团的不同可分为:烯烃、羧酸、醇类、卤代烃、酯类和酚类,总共6类,
故选B.
点评 本题考查有机物的简单分类、对官能团的认识等,比较基础,注意醇羟基与酚羟基的区别在于羟基是否直接连接苯环.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3晶体 | B. | NaOH晶体 | C. | CuSO4溶液 | D. | CH3COONa晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶液显碱性:C6H5O-+H2O?C6H5OH+OH- | |
| B. | HSO3-在溶液中发生水解:HSO3-+H2O?SO32-+H3O+ | |
| C. | 向Mg(OH)2浊液中滴加FeCl3溶液生成红褐色沉淀:3OH-+Fe3+=Fe(OH)3↓ | |
| D. | 惰性电极电解MgCl2溶液:Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ OH-+Cl2↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | V | |||
| X | W |
| A. | 少量Z的单质与过量W的单质可化合生成ZW2 | |
| B. | 甲、乙反应的生成物为离子晶体,但其中含有共价键 | |
| C. | 电负性大小关系是:X>Y>V>W | |
| D. | 甲中的V原子杂化类型是sp2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、H2O、Al均为非电解质 | |
| B. | 以碳做电极,通电后H2SO4完全电离了,并且产生了H2和O2,溶液pH降低 | |
| C. | 由非金属元素构成的物质中一定全部为共价键 | |
| D. | 同主族的元素间也可以构成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | NH3 | C. | SO3 | D. | Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②④⑤ | C. | ②④⑥ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| M | |
| T |
 ,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为
,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com