
【题目】下列说法正确的是 ( )
A. 1mol氢 B. 1.5molH2O C. 2mol铁钉 D. 3mol西瓜
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeS04,较多的Cu2+和少量Na+。该工厂计划从废水中回收FeS04和金属铜。根据下列流程图,同答问题。
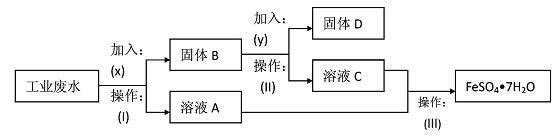
(1)加入的试剂x为____,y为____;
(2)加入试剂y发生反应的离子方程式是_______;
(3)操作(I)为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置制取并收集氨气,请回答下列问题:
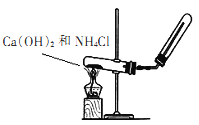
(1)写出大试管内发生反应的化学方程式:_____________。
(2)下列气体能采用如图收集方式的是___。
A.O2 B.NO C.H2
(3)若反应收集了336mL标况下氨气,将其配制成500mL溶液,其物质的量浓度为____mol/L。
(4)另取上述(3)所得溶液配制成0.0lmol/L溶液l00mL的过程中,不需要使用的仪器是(填代号)___。
A.烧杯 B.胶头滴管 C.玻璃棒 D.l00mL容量瓶 E.漏斗
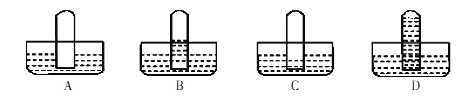
(5)某学生欲试验氨气的水溶性,将集满干燥氨气的试管倒置于水中,则其观察到的现象应该与______图一致。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民生产中占有重要的地位.工业合成氨的反应为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4KJ/mol.请回答下列问题:
(1)表明合成氨反应处于平衡状态的是(填字母)
a.2v正(NH3)>3v逆(H2)b.c(N2)=c(H2)>c(NH3)
c.单位时间内有3molH﹣H键断裂,同时有6molN﹣H键断裂
d.恒温恒容时,容器内压强不变
e.恒温恒容时,容器内混合气体的弥补不变
(2)在一定条件下的密闭容器中,该反应达到平衡,既要加快反应速率,又要提高H2的转化率,可以采取的措施有(填字母)
a.升高温度 b.分离出液态氨气 c.增加N2浓度 d.增加H2浓度
(3)已知在400℃时,N2(g)+3H2(g)2NH3(g)的平衡常数K=0.5,则NH3(g)N2(g)+3H2(g)的平衡常数表达式为K= , 数值为 .
(4)有两个密闭容器A和B,A容器保持恒容,B容器爆出恒压,起始时向容积相等的A、B中分别通入等量的NH3气体,均发生反应:2NH3(g)3H2(g)+N2(g).则:
①达到平衡所需的时间:t(A)t(B),平衡时,NH3的转化率:a(A)a(B)(填“>”、“=”或“<”).
②达到平衡后,在两容器中分别通入等量的氦气.A中平衡向移动,B中平衡向移动.(填“向正反应方向”、“向逆反应方向”、“不”).
(5)在三个相同容器中各充入1molN2和3molH2 , 在不同条件下反应并达到平衡,氨的体积分数[Ψ(NH3)]随时间变化的曲线如图所示.下列说法中正确的是(填字母,下同). 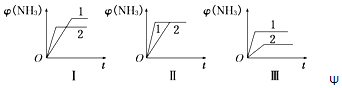
a.图Ⅰ可能是不同压强对反应的影响,且p2>p1
b.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
c.图Ⅲ可能是不同温度对反应的影响,且T1>T2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验并回答:
如图1所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c 三个棉球变化如下表(认为所产生的气体与棉球上的试剂均得到充分的反应)。则浓硫酸在该反应中表现的性质_________________;
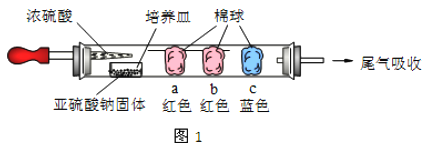
棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
a | ___________ | 棉球变白,微热后又恢复红色 | 该气体具有______性。 |
b | 含酚酞的NaOH 溶液 | 棉球变为白色 | 离子方程式_________ |
c | __________ | 棉球变为白色 | 化学方程式___________,该气体具有_______性。 |
II.通常情况下,向硫酸亚铁溶液中滴加氢氧化钠溶液时,生成的白色絮状沉淀会迅速变为_____色,最终变为____色写出上述白色絮状沉淀变化过程的化学方程式_______;
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一: 用不含O2的蒸馏水配制的NaOH 溶液与硫酸亚铁反应制备。
(1)除去蒸馏水中溶解的O2常采用_________的方法。
(2)生成白色Fe(OH)2 沉淀的操作是用长滴管吸取不含O2的NaOH 溶液,插入FeSO4溶液液面下,再挤出NaOH 溶液。
方法二: 如右图装置中,用NaOH 溶液、铁屑、稀H2SO4等试剂制备。
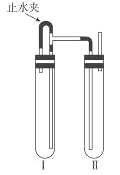
(1)在试管I里加入的试剂是___________。
(2)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后,检验试管II出口处排出的氢气的纯度。当排出的氢气纯净时,再________(如何操作)。这样生成的Fe(OH)2 沉淀能较长时间保持白色。原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3反应的化学方程式:_________________________________________。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+2SO![]() +4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
+4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①____SeO2+____I-+____H+===____Se+____I2+____H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程式①,并标出电子转移的方向和数目。_____________
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol·L-1的Na2S2O3溶液25.00 mL,所测样品中SeO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据卤素性质的递变规律,推测原子半径最大的卤素-----砹(At)及其化合物不可能具有的性质是
A.砹单质为有色固体,易溶于有机溶剂;B.HAt十分稳定;
C.AgAt为有色的、难溶于水的盐;D.NaAt易溶于水。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com