
| A、除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 |
| B、混入Cl2中的HCl气体,可用饱和NaCl溶液除去 |
| C、除去Fe粉中的少量铝粉:加入NaOH溶液后过滤 |
| D、提取溶解在水中的少量溴:加入CCl4,振荡,静置,分层后,取出有机层再分离 |
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
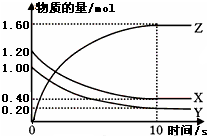 (1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁分别加入浓硫酸和氢氧化钠溶液中均无明显现象 |
| B、H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率 |
| C、漂白粉溶液和硅酸钠溶液久置空气中都变质 |
| D、SO2既能使品红褪色也能使酸性高锰酸钾褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使石蕊试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl-能大量共存 |
| B、含有大量AlO2-的溶液中:Na+、Ba2+、Cl-、HCO3- 能大量共存 |
| C、澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl-不能大量共存 |
| D、c(H+)=0.1mol?L-1的溶液中:Na+、Mg2+、SO42-、ClO-不能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2 L |
| B、33.6 L |
| C、22.4 L |
| D、44.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水,浓H2SO4 |
| B、KMnO4酸性溶液,浓H2SO4 |
| C、浓H2SO4,KMnO4酸性溶液 |
| D、溴水,烧碱溶液,浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
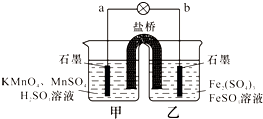 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )| A、乙烧杯中发生还原反应 |
| B、甲烧杯中溶液的pH逐渐减小 |
| C、电池工作时,盐桥中的SO42-移向甲烧杯 |
| D、外电路的电流方向是从a到b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com