
【题目】为测定抗贫血药物复方硫酸亚铁中铁的含量,某化学学习小组进行了以下实验研究。
【实验原理】有些溶液本身无色,但加入其他试剂后会有明显的颜色,溶液颜色的深浅和浓度有关,通过比较颜色的深浅可测定物质的含量。
【实验用品】2.00×10-2 mol/L Fe3+的标准溶液、蒸馏水、5%KSCN溶液、pH=4的HAc-NaAC缓冲溶液、1∶1HNO3溶液、复方硫酸亚铁药片。
铁架台(铁夹)、100 ml容量瓶、胶头滴管、量筒、烧杯、三脚架、石棉网、酒精灯、玻璃棒、25 mL比色管、pH试纸。
【实验过程】
Ⅰ.配制系列标准溶液:分别量取2.00×10-2 mol/L Fe3+的标准溶液6.00 mL、6.50 mL、7.00 mL、7.50 mL置于4支25 mL比色管中,再加入1.0 mL5%KSCN溶液和2.5 mLpH=4的HAc-NaAc缓冲溶液,加蒸馏水稀释至刻度。
Ⅱ.制取待测液:取1片复方硫酸亚铁药片,准确称量其质量,置于50 mL烧杯中,加入2 mL蒸馏水溶解,再加入2 mL1∶1 HNO3溶液,小心加热2~3 min。冷却后,全部移入100 mL容量瓶中,再加入4.0 mL5%KSCN溶液和10.0 mLpH=4的HAc-NaAc缓冲溶液等,振动、定容、摇匀制得待测液100 mL。取25.00 mL待测液加入与Ⅰ中相同规格的比色管中。
Ⅲ.比色:将Ⅱ所得比色管中的溶液与Ⅰ中各比色管中的溶液进行比较,确定待测液中Fe3+的浓度范围。
请回答下列问题:
(1)在含有Fe3+的溶液中加入KSCN溶液,溶液显色。
(2)完成该实验,还缺少的仪器有、。
(3)加入pH=4的HAc-NaAc缓冲溶液的目的是?
(4)实验中量取HNO3溶液、HAc-NaAc缓冲溶液用量筒即可,原因是?
(5)标准溶液的浓度过大或过小均对实验结果有影响,则浓度过小对实验结果造成的影响是?
(6)若测得待测液中Fe3+的物质的量浓度为c mol/L,药片的质量为m , 则药片中铁元素的质量分数为?
【答案】
(1)血红
(2)分析天平;酸式滴定管
(3)
调节溶液的pH,使溶液呈酸性(抑制Fe3+水解)
(4)
HNO3溶液、HAc-NaAc缓冲溶液在实验中是辅助试剂,不必精确量取
(5)
使比色管中色阶的颜色差变小,不易观察
(6)
25.00 mL待测液中所含药片的质量为 ![]() g,铁元素的质量为c mol/L×25×10-3 L×56 g/mol=1.4c g,故铁元素的质量分数为
g,铁元素的质量为c mol/L×25×10-3 L×56 g/mol=1.4c g,故铁元素的质量分数为 ![]() ×100%=
×100%= ![]() ×100%。
×100%。
【解析】(1)Fe3+遇SCN-变为血红色。(2)该实验中准确称取1片复方硫酸亚铁药片需要用到分析天平,取用待测液需要用到酸式滴定管。(3)加入pH=4的HAc-NaAc缓冲溶液主要是调节溶液的pH,使溶液呈酸性,抑制Fe3+水解。(4)HNO3溶液、HAc-NaAc缓冲溶液在实验中是辅助试剂,不必精确量取,因此量取时用量筒即可。(5)标准溶液的浓度过小,比色管中色阶的颜色差变小,不易观察。(6)25.00 mL待测液中所含药片的质量为 ![]() g,铁元素的质量为c mol/L×25×10-3 L×56 g/mol=1.4c g,故铁元素的质量分数为
g,铁元素的质量为c mol/L×25×10-3 L×56 g/mol=1.4c g,故铁元素的质量分数为 ![]() ×100%=
×100%= ![]() ×100%。
×100%。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,如下措施中①向盐酸中加少量水;②将铁粉换成铁片;③升高温度:④将盐酸换成与之等体积等浓度的硫酸,能达到目的有( )
A.②④B.①②C.②③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题: 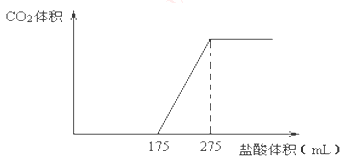
(1)加入盐酸后总共产生的气体在标准状况下的体积为L;
(2)盐酸中HCl的物质的量浓度;
(3)反应后的固体的成分(填化学式);
(4)x= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人的血液里Ca2+的浓度一般采用g·cm-3表示,今抽一血样20.00 mL加入适量的草酸铵[(NH4)2C2O4]溶液,可析出CaC2O4沉淀,将沉淀冼净后溶于强酸可得草酸,再用浓度为0.02 mol·L-1的KMnO4溶液滴定。当观察到溶液紫色褪尽时,共消耗12.00 mL KMnO4溶液。则该血液样品中Ca2+的浓度为( )
A.0.0015 g·cm-3
B.0.0012 g·cm-3
C.0.0024 g·cm-3
D.0.002 g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A与盐酸反应生成B和氢气,D为单质。根据上图回答下列问题:

(1)C的化学式为_______;B+D→C的化学方程式为______________。
(2)B与氨水反应的现象为___________________________________,请写出该现象的离子方程式______________;_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.1mol H2O的质量是18g·mol-1B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32克D.标况下1mol乙醇的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3﹣、Cl﹣、NO | 不能大量共存, |
B | 由水电离出的H+浓度为1×10﹣12molL﹣1 | NH4+、Na+、NO | 一定能大量共存,NH4++H2ONH3H2O+H+ |
C | pH=1的溶液 | Fe2+、Al3+、SO | 不能大量共存,5Fe2++MnO4﹣+8H+═Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO﹣、SO | 不能大量共存,2ClO﹣+SO2+H2O═2HClO+SO |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是____________。
(2)根据框图反应关系,写出下列B、C、D、E所含物质的化学式

沉淀固体B_________;C_________;沉淀D ___________。
(3)写出②的离子反应方程,③的化学反应方程。
②_________________________________;
③_________________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com