
����Ŀ����A��BΪԭ�Ϻϳɱ�����������F��·����ͼ��ʾ��

��1��A����ʽΪC2H2O3���ɷ���������Ӧ���Ҿ������ԣ�A��������������Ϊ__________��
��2��A+BC�ķ�Ӧ����Ϊ_______��A��ˮ��Һ����������������ͭ����Һ����,��Ӧ�Ļ�ѧ����ʽΪ_______��C( )������̼ԭ�������ӵ��ǻ��ڢ٢ڢ���������_______���ǿ������������
)������̼ԭ�������ӵ��ǻ��ڢ٢ڢ���������_______���ǿ������������
��3��B�����������_______��ԭ�ӹ��棬��B��ˮ��Һ�еμ�Ũ��ˮ������_______��F�ڼ���������������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ_______��
��4��E����2����C���ɵĺ���3����Ԫ���Ļ����E���ӵĽṹ��ʽΪ_______��
��5���ڷ�������������F��ͬ���칹��(�����������칹)�У��˴Ź������������������ʵĽṹ��ʽΪ____________
������һԪ�������ڱ�����ֻ��2��ȡ�����Ҵ��ڶ�λ������һ�����ǻ���
��6����֪��![]() ��A�ж��ֺϳɷ������ڷ�����д��������ϳ�A��·������ͼ(����ԭ����ѡ)��_______
��A�ж��ֺϳɷ������ڷ�����д��������ϳ�A��·������ͼ(����ԭ����ѡ)��_______
���𰸡�ȩ�����Ȼ� �ӳɷ�Ӧ OHC-COOH+2Cu(OH)2+2NaOH![]() NaOOC-COONa+Cu2O��+4H2O �� 13 ������ɫ����
NaOOC-COONa+Cu2O��+4H2O �� 13 ������ɫ����  +3NaOH��
+3NaOH�� +CH3OH+NaBr+H2O
+CH3OH+NaBr+H2O 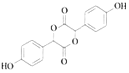
 CH3COOH
CH3COOH![]() ClCH2COOH
ClCH2COOH![]() HOCH2COONa
HOCH2COONa![]() HOCH2COOH
HOCH2COOH![]() OHC-COOH
OHC-COOH
��������
A�ķ���ʽΪC2H2O3���ɷ���������Ӧ���Ҿ������ԣ�˵������ȩ�����Ȼ�����A�Ľṹֻ��ΪOHC-COOH������C�Ľṹ��֪B��![]() ��
��
(1)A����������Ϊȩ�����Ȼ���
(2)A��B�Ĺ�����A��̼��˫�����ֱ����ӱ�������ԭ�ӣ�Ϊ�ӳɷ�Ӧ������������ͭ����Һ���й�����NaOH������A���Ȼ���Ӧ����������������������ͭ��������A��ȩ�������Ȼ����ٺ�NaOH��Ӧ�����Է���ʽΪOHC-COOH+2Cu(OH)2+2NaOH![]() NaOOC-COONa+Cu2O��+4H2O��C������̼ԭ��Ϊ�ں��ǻ�����̼ԭ�ӣ��ٺ��ǻ��ܱ���Ӱ�����Խ�ǿ���ۺ��ǻ�Ϊ�Ȼ��е��ǻ���������ǿ���ں��ǻ�����������
NaOOC-COONa+Cu2O��+4H2O��C������̼ԭ��Ϊ�ں��ǻ�����̼ԭ�ӣ��ٺ��ǻ��ܱ���Ӱ�����Խ�ǿ���ۺ��ǻ�Ϊ�Ȼ��е��ǻ���������ǿ���ں��ǻ�����������
(3)BΪ![]() ��������12��ԭ��ȫ�����棬���ⵥ��������ת�����������13��ԭ�ӹ��棻���ӿ��Ժ�Ũ��ˮ����ȡ����Ӧ���ɲ�����ˮ��2,4,6���屽�ӣ���������Ϊ������ɫ������F����ԭ����NaOHˮ��Һ����ˮ�⣬���ǻ����Ժ�NaOH��Ӧ������ˮ�������Ȼ����Ժ�NaOH��Ӧ�����Է�Ӧ����ʽΪ��
��������12��ԭ��ȫ�����棬���ⵥ��������ת�����������13��ԭ�ӹ��棻���ӿ��Ժ�Ũ��ˮ����ȡ����Ӧ���ɲ�����ˮ��2,4,6���屽�ӣ���������Ϊ������ɫ������F����ԭ����NaOHˮ��Һ����ˮ�⣬���ǻ����Ժ�NaOH��Ӧ������ˮ�������Ȼ����Ժ�NaOH��Ӧ�����Է�Ӧ����ʽΪ�� +3NaOH��
+3NaOH�� +CH3OH+NaBr+H2O��
+CH3OH+NaBr+H2O��
(4)C�����ǻ����Ȼ���2����C���Է������Ӽ�������Ӧ����������3����Ԫ���Ļ������EΪ ��
��
(5)FΪ ����ͬ���칹�����㣺������һԪ���������Ժ���һ���Ȼ����ڱ�����ֻ��2��ȡ�����Ҵ��ڶ�λ������һ�����ǻ�������һ��ȡ����Ϊ��-CBr(CH3)COOH��-CH(CH2Br)COOH��-CH2CHBrCOOH��-CHBrCH2COOH���˴Ź���������������Ϊ
����ͬ���칹�����㣺������һԪ���������Ժ���һ���Ȼ����ڱ�����ֻ��2��ȡ�����Ҵ��ڶ�λ������һ�����ǻ�������һ��ȡ����Ϊ��-CBr(CH3)COOH��-CH(CH2Br)COOH��-CH2CHBrCOOH��-CHBrCH2COOH���˴Ź���������������Ϊ ��
��
(6)�Ա�CH3COOH��OHC-COOH��֪����Ҫ�������еļ�ת��Ϊȩ����ȩ���������ǻ��������ɣ�±ԭ�ӿ���ˮ�������ǻ���������Ŀ������Ϣ��֪�����еļ���PCl3/���������·�Ӧ����±ԭ�ӣ����Ժϳ�·��Ϊ��CH3COOH![]() ClCH2COOH
ClCH2COOH![]() HOCH2COONa
HOCH2COONa![]() HOCH2COOH
HOCH2COOH![]() OHC-COOH��
OHC-COOH��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(��ͼ)��������������ҩ����Ұ���ܲ�����Ҷˮ�ա�������С���������ֹѪ���á����й��ڿ������˵������ȷ����
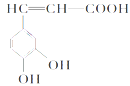
A.������ķ���ʽΪC9H8O4
B.1 mol��������Ժͺ�4 molBr2��Ũ��ˮ��Ӧ
C.1 mol������������NaHCO3��Һ��Ӧ�ܲ��������Լ67.2L��CO2
D.�������ø�����ؼ��鿧��������е�̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ԫ���� H3A �ڱ�����Լ���ϴ�Ӽ������ȷ��������Ҫ�ĵ�λ������ʱ���� 10 mL 0.01 mol��L1 �� H3A ��Һ�е��� 0.01 mol��L1 �� NaOH ��Һ��H3A��H2A��HA2��A3�����ʵ�����������Һ�� pH �Ĺ�ϵ�� ͼ��ʾ������˵���������( )
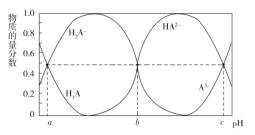
A.���¶��£�H3A �ĵ��볣�� Ka1=10a
B.�� b=7������ 20 mL NaOH ��Һʱ����Һ�� pH��7
C.NaOH ��Һ�����Ϊ 30 mL ʱ����Һ�У�c(OH)=3c(H3A)��2c(H2A)��c(HA2)��c(H+)
D.��Ӧ 2H2A![]() H3A��HA2�ڸ��¶��µ�ƽ�ⳣ��K=10a-b
H3A��HA2�ڸ��¶��µ�ƽ�ⳣ��K=10a-b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������amol AlCl3��Һ�м��뺬��bmol KOH��Һ�����ɳ��������ʵ���������
��amol ��bmol ��a/3mol ��b/3mol ��0 mol ��(4a-b)mol
A.�٢ۢܢݢ�B.�٢ڢۢܢ�C.�٢ܢݢ�D.�٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL0.1molL��1��H2A����Ԫ���ᣩ��Һ�еμ�0.1mol/L��NaOH��Һ����ҺpH��NaOH��Һ����ı仯��ͼ��ʾ������˵����ȷ����
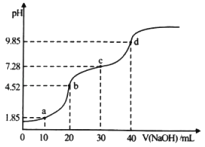
A.a�����Һ�У�c��Na+����c��A2����c��HA����c��H+����c��OH��
B.b�����Һ�У�c��H2A��+c��H+����c��A2��+c��OH��
C.c����Һ��pH��7������Ϊ��ʱHA�ĵ�������С����ˮ������
D.����0.1molL��1��NaOH��Һ����ͬŨ�ȵİ�ˮ�����μ�40mLʱ����ʱ��Һ��pH��9.85
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ����㷺�Ľ����������Ȼ���������Լ������ĺ������ξ�Ϊ��Ҫ�����
��1����ʵ�����У�FeCl2�������ۺ�___(������)��Ӧ�Ʊ���
��2��Fe3O4���ö��ַ����Ƶã�������һ�ֵ��ʺ�һ�ֻ�����ͨ�����Ϸ�Ӧ�Ʊ��Ļ�ѧ����ʽΪ___��
��3��ʵ�������Ʊ�Fe(OH)2ʱ���������������������������___����Ӧ�Ļ�ѧ����ʽΪ___��
��4����ש������������ս���ɵģ����京��Fe2O3�ʺ�ɫ���غ�ɫ���������������������ϡ������һ����ʵ��֤����ש�к���Fe3+��___��
��5������һ����FeCl2��FeCl3�Ļ������Ʒ��ʵ����n(Fe)��n(C1)=1��2.1�������Ʒ��FeCl3�����ʵ�������Ϊ___��
��6���������(K2FeO4)��һ��ǿ������������Ϊˮ��������������ز��ϡ�FeCl3��KClO��ǿ���������·�Ӧ����ȡK2FeO4���䷴Ӧ�����ӷ���ʽΪ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Ĺ�ҵ��ˮ�к��д�����FeSO4�ͽ϶��Cu2+��Ϊ�˼�����Ⱦ���Ϊ���������ƻ��Ӹ÷�ˮ�л������������ͽ���ͭ�����������ͼ����ͼ�����ش��������⡣

��1�������������õ�������____��
��2������A�ijɷ���___��____���������ƣ�����������____��
��3����μ�����Һa����Ҫ������____��
��4�����յ�ͭ���������Ʊ�������CuSO4��5H2O������ͭ��0.22mol/LH2SO4��Һ��Ϻ��ڼ��ȵ�����²���ͨ�������Ϳ����Ƶ�CuSO4��Ȼ�����õ���Һ������һϵ�в�������õ�������д������CuSO4�Ļ�ѧ����ʽ��___��
��5��ijͬѧ���ܶ�Ϊ1.84g/cm3����������Ϊ 98%��Ũ������500mL0.22mol/L��ϡ������Һ����Ҫ�ù��Ϊ___mL����Ͳ��ȡ___mL��Ũ���ᡣ
��6�����Ƹ���Һ�Ĺ����У����в���ʹ������õ���ҺŨ��ƫС����___(����ĸ)��
A��ϡ���ܶ�Ϊ1.84g/cm3����������Ϊ 98%��Ũ����ʱ����С�Ľ�������������Һ
B��������ˮϴ���ձ�����Ͳ��������������ϴ��Һע������ƿ��
C������ʱ�������µ�ת����ƿ���ְ�Һ����ʹ����ڿ̶��ߣ��ٲ���ˮ���̶���
D����ȡ�ܶ�Ϊ1.84g/cm3����������Ϊ 98%��Ũ����ʱ��������Ͳ�Ŀ̶���
E��ϴ������ƿ����������������Һ
F��ϡ��Ũ�����������������Һת�Ƶ�����ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪3CuO+2NH3![]() 3Cu+N2+3H2O�������ж���ȷ����
3Cu+N2+3H2O�������ж���ȷ����
A.NԪ�صĻ��ϼ۽���B.NH3����ԭ
C.����0.3 mol CuOת��0.6 NA������D.CuO�ǻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ˮ��25 ���95 ��ʱ�ĵ���ƽ��������ͼ��ʾ��
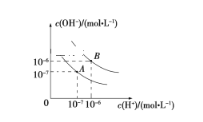
��1��25 ��ʱˮ�ĵ���ƽ������ӦΪ__________ (����A������B��)��
��2��95 ��ʱˮ�����ӻ�Kw=__________��cH��==__________
��3��25 ��ʱ����pH=9��NaOH��Һ��pH=4��H2SO4��Һ��ϣ������û����Һ��pH=7����NaOH��Һ��H2SO4��Һ�������Ϊ_____��
��4��95 ��ʱ����100 mL pH1=a��ijǿ����Һ��1 mL pH2=b��ijǿ����Һ��Ϻ�������Һ�����ԣ�����ǰ����ǿ���pH1��ǿ���pH2֮��Ӧ����Ĺ�ϵ��____��
��5��������B��Ӧ���¶��£���pH=2��ijHA��Һ��pH=10��NaOH��Һ�������ϣ�������Һ��pH=5���������ԭ��_________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com