
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。
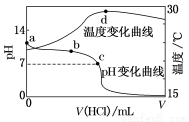
下列有关说法正确的是( )
A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B.b点:c(NH )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH )
)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
C
【解析】本题考查电解质溶液中的离子浓度关系,意在考查学生对化学图像的分析能力及对酸碱中和滴定和混合溶液中离子浓度关系的掌握情况。a点即是1.000 mol·L-1的氨水,NH3·H2O是弱电解质,未完全电离,c(OH-)<1 mol·L-1,水电离出的c(H+)>1.0×
10-14 mol·L-1,A项错误;b点处,加入盐酸的体积未知,不能进行比较,B项错误;c点溶液显中性,即c(OH-)=c(H+),结合电荷守恒关系:c(OH-)+c(Cl-)=c(H+)+c(NH ),有
),有
c(Cl-)=c(NH ),C项正确;d点后,溶液温度下降是由于加入的冷溶液与原溶液发生热传递,D项错误。
),C项正确;d点后,溶液温度下降是由于加入的冷溶液与原溶液发生热传递,D项错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:填空题
10℃时加热饱和NaHCO3溶液,测得该溶液的pH发生如表所示的变化。
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液pH增大的原因是HCO 的水解程度增大,故碱性增强,有关反应的离子方程式为__________________________。乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为______________________________。
的水解程度增大,故碱性增强,有关反应的离子方程式为__________________________。乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为______________________________。
丙同学认为,甲、乙的判断都不充分,他进行如下探究来验证他们的判断是否正确。
(1)在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确,试剂X是________(填序号)。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH________(填“大于”“小于”或“等于”)8.3,则________(填“甲”或“乙”)的判断正确。
(3)丙同学查阅资料后发现,NaHCO3的分解温度为150℃,他断言________(填“甲”或“乙”)的判断是错误的,原因是________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
在生产和生活中,人们广泛利用着化学反应释放的能量。下列说法正确的是( )
A.物质发生化学变化并不一定都伴随着能量变化
B.用实验方法和理论方法研究反应热的化学称为热化学
C.有能量变化的都是化学变化
D.任何反应中的能量变化都表现为热量变化
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
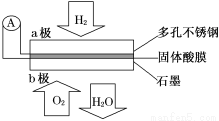
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为: O2+2H2O+4e-=4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:填空题
现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是____________。
(3)已知t°C,KW=1×10-13,则t°C______(填“>”、“<”或“=”)25°C。
(4)25°C时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和。两溶液的pH(x、y)的关系式为________________(填表达式)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,下列有关该盐溶液的比较,不正确的是( )
A.c(SO )>c(NH
)>c(NH )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
B.c(SO )=c(NH
)=c(NH )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
C.2c(SO )+c(OH-)=c(NH
)+c(OH-)=c(NH )+2c(Fe2+)+c(H+)
)+2c(Fe2+)+c(H+)
D.c(NH )+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2]
)+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2]
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.在Na2CO3溶液中滴入酚酞试液,呈红色
B.(NH4)2SO4溶液中c(NH )∶c(SO
)∶c(SO )=2∶1
)=2∶1
C.FeCl3溶于水使溶液呈酸性,从而抑制水的电离
D.将Al2(SO4)3溶液蒸干得到Al(OH)3固体
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:选择题
有一化学平衡mA(g)+nB(g)  pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是( )
pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是( )
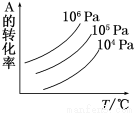
A.正反应是放热反应;m+n>p+q
B.正反应是吸热反应;m+n<p+q
C.正反应是放热反应;m+n<p+q
D.正反应是吸热反应;m+n>p+q
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第四章 电化学基础练习卷(解析版) 题型:选择题
1 L某溶液中含有的离子如下表:
离子 | Cu2+ | Al3+ | NO | Cl- |
物质的量浓度(mol/L) | 1 | 1 | a | 1 |
用惰性电极电解该溶液,当电路中有3 mol e-通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是( )
A.电解后溶液的pH=0 B.a=3
C.阳极生成1.5 mol Cl2 D.阴极析出的金属是铜与铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com