
【题目】利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系
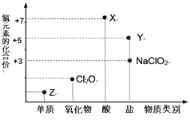
回答下列问题:
(1)X的电离方程式为________。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=______。
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y含有的化学键类型为__;Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,生成的两种盐的化学式分别__。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的__倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为__。
【答案】HClO4=H++ClO4- 2:3或![]() 离子键、极性共价键或共价键或极性键 KCl、KClO4 2 2Cl2+2Na2CO3+H2O=2NaCl+2NaHCO3+Cl2O
离子键、极性共价键或共价键或极性键 KCl、KClO4 2 2Cl2+2Na2CO3+H2O=2NaCl+2NaHCO3+Cl2O
【解析】
(1)X是氯元素的+7价的酸,则X为HClO4,高氯酸为强酸,完全电离,其电离方程式为HClO4=H++ClO4-;
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则有![]() ,故有m:n=2:3;
,故有m:n=2:3;
(3)Y可用于实验室制O2,其焰色试验为紫色,故含有K元素,Y中氯元素的化合价为+5价,则Y为KClO3,含有的化学键类型为离子键、极性共价键或共价键或极性键;KClO3在400℃时分解只生成两种盐,其中一种是无氧酸盐KCl,另一种盐的阴阳离子个数比为1:1,KClO3、KCl中氯元素的化合价分别为+5、-1,根据化合价变化及氧化还原反原理可知,另一种盐中氯元素的化合价应高于+5价,且氯元素的价态一般为奇数价,故为KClO4,即生成的两种盐的化学式分别为KCl、KClO4;
(4)Z是氯元素形成的单质,则为Cl2,NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Cl2的![]() =2倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示);
=2倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示);
(5)Cl2O可用潮湿的Cl2与Na2CO3反应制取,同时生成NaHCO3,反应中Cl2既体现氧化性,又体现还原性,Cl2O中氯为+1价,生成Cl2O时氯气体现还原性,则生成物中还有含氯化合价小于0的,则为Cl-,即有NaCl生成,结合氧化还原反应配平得反应的化学方程式为2Cl2+2Na2CO3+H2O=2NaCl+2NaHCO3+Cl2O。


科目:高中化学 来源: 题型:
【题目】室温时,向20mL 0.1mol/L的CH3COOH溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
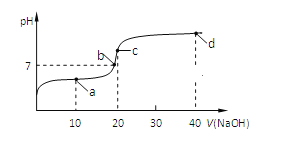
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+)<c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+)>c(OH-) > c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型示意图,下列说法正确的是
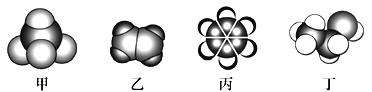
A. 甲能发生氧化反应
B. 乙通入溴的四氯化碳溶液,最后得到无色溶液不能和液溴反应
C. 煤干馏得到的煤焦油可以分离出丙,丙是无色无味的液态烃
D. 丁发生催化氧化得到的产物不能与金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上,对过氧化氢的分子结构有过不同观点,下图两种对结构的猜测中有一种正确,请选用合理实验加以证明
猜想Ⅰ: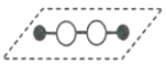 猜想Ⅱ:
猜想Ⅱ: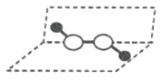
A.测定过氧化氢的沸点
B.测定过氧化氢分解时吸收的能量
C.测定过氧化氢分子中的氢氧键与氧氧键键长
D.观察过氧化氢细液流在电场中是否发生偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】规律提炼题组:同分异构体的书写
(1)同温同压下蒸气的密度是H2的43倍的烷烃的分子式________,其中一氯代物只有2种的结构简式为:_______________________。
(2)写出符合下列条件 的所有同分异构体的结构简式_______。
的所有同分异构体的结构简式_______。
a.苯环上只有两个取代基且互为邻位
b.既能发生银镜反应又能发生水解反应
(3)CH2=CHOC2H5的同分异构体,与CH2=CHOC2H5有完全相同的官能团,写出所有可能的结构________。
学法题:通过此题的解答,总结同分异构体常见类型有____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中泄露的二氧化硫,会被氧化而形成硫酸雾或硫酸盐气溶胶,污染环境。工业上常用![]() 溶液吸收、活性炭还原等方法处理二氧化硫,以减小对空气的污染。
溶液吸收、活性炭还原等方法处理二氧化硫,以减小对空气的污染。
(1)写出用![]() 溶液吸收
溶液吸收![]() 的离子方程式____________。
的离子方程式____________。
(2)钠原子核外有______种能量不同的电子。写出硫原子最外层电子的轨道表示式____________。
(3)![]() 比
比![]() 稳定,请用分子结构的知识简述其理由。__________________
稳定,请用分子结构的知识简述其理由。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是
A.1 mol苯分子中含有C=C双键数目为3NA
B.标准状况下,11.2L CH3Cl中含有的共价键数目为2NA
C.常温常压下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
D.17 g甲基(﹣14CH3)所含中子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )

A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
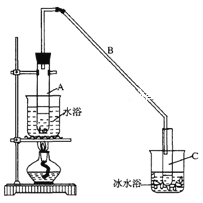
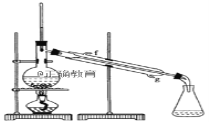
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: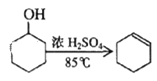 +H2O
+H2O
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至
反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是____________
② 试管C置于冰水浴中的目的是______________________________________________
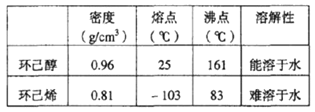
(2)制备精品
① 环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填:上、下),分液后用__________洗涤。
A KMnO4溶液 B 稀H2SO4 C Na2CO3溶液
② 再将环己烯按如图装置蒸馏,冷却水从_____口(填g或f)进入。
③ 收集产品时,控制的温度应在_____左右,实验制得的环己烯精品质量低于理论产量,可能的原因是___________
a 蒸馏时从70℃开始收集产品 b 环己醇实际用量多了 c 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_____
A用酸性高锰酸钾溶液 B 用金属钠 C 测定沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com