
【题目】短周期元素a、b、c、d、e在周期表中的相对位置如图所示。已知a元素形成的物质种类最多。
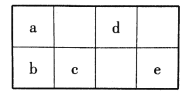
回答下列问题:
(1)在周期表中,b在元素周期表中的位置为______。
(2)b、c、e的气态氢化物热稳定性由强到弱的顺序为_____(用化学式表示)。
(3)在d的氢化物中,既含极性键又含非极性键的分子的电子式为____。
(4)a的单质在过量的d的单质气体中燃烧生成气态产物,转移1mol电子时放出的热量为98.75kJ。写出反应的热化学方程式:_______。
(5)请写出e单质与石灰乳制成漂白粉的化学方程式________。
【答案】第三周期第ⅣA族 HCl>PH3>SiH4 ![]() C(s)+O2(g)=CO2(g)△H=-395kJ/mol 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C(s)+O2(g)=CO2(g)△H=-395kJ/mol 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
(1)根据b在元素周期表的位置,推出b为Si元素,所以Si在第三周期第ⅣA族;
(2)根据元素周期表的位置推断,b、c、e分别为Si、P、Cl,氢化物的热稳定性与它的非金属性有关,同一周期依次递增,所以HCl>PH3>SiH4;
(3)在d的氢化物中,既含极性键又含非极性键的分子是过氧化氢;
(4)根据燃烧热的定义进行书写,要注意1mol纯物质;
(5)氯气和氢氧化钙反应生成次氯酸钙、氯化钙和水。
(1)根据周期数和主族数得出;
(2)根据元素周期表的位置推断,b、c、e分别为Si、P、Cl,热稳定性根据非金属性来判断;
(3)在d的氢化物中,既含极性键又含非极性键的分子是过氧化氢,电子式为![]() ;
;
(4)根据燃烧热的定义进行书写,要注意1mol纯物质,C变成CO2失去4个电子,所以方程式为C(s)+O2(g)=CO2(g)△H=-395kJ/mol;
(5)氯气和氢氧化钙反应生成次氯酸钙、氯化钙和水,方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的说法不正确的是( )
A.燃料电池属于二次电池
B.铜锌原电池工作时,电流沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“>”“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)===2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。
(2)相同条件下,2 mol氢原子所具有的能量______1 mol氢分子所具有的能量。
(3)已知常温下红磷比白磷稳定,比较下列反应中(反应条件均为点燃)ΔH的大小:ΔH1______ ΔH2。
①P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1,
②4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2。
(4)已知:101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则碳的燃烧热数值________110.5 kJ·mol-1。
(5)已知:稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量________57.3 kJ;稀硫酸和稀氢氧化钡溶液中和生成1 mol 水放出的热量_______________57.3 kJ。
(6)已知一定条件下合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。
2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4P(红磷s) ![]() P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是
P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是
A.当lmol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.白磷热稳定性比红磷大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,其中离子交换膜I、II分别是氯离子交换膜和钠离子交换膜中的一种,图中有机废水中的有机物可用C6H10O5表示。下列有关说法正确的是

A. a电极为该电池的负极,离子交换膜I是钠离子交换膜
B. a电极附近溶液的氯离子浓度增大,b电极附近溶液的pH减小
C. a电极的电极反应式为C6H10O5-24e-+7H2O=6CO2↑+24H+
D. 中间室中Na+移向左室,Cl—移向右室
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com