
| A、先加NaOH,后加Na2CO3,再加BaCl2 |
| B、先加NaOH,后加BaCl2,再加Na2CO3 |
| C、先加BaCl2,后加NaOH,再加Na2CO3 |
| D、先加Na2CO3,后加BaCl2溶液,再加NaOH |


科目:高中化学 来源: 题型:
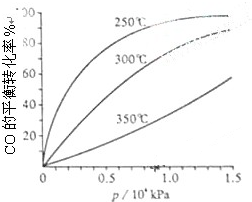 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
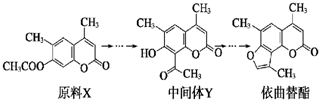
| A、原料X与中间体Y互为同分异构体 |
| B、原料X可以使酸性KMnO4溶液褪色 |
| C、中间体Y能发生加成、取代、消去反应 |
| D、1 mol依曲替酯只能与1 mol NaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,正丁烷的燃烧热为-2878.0kJ/mol |
| B、相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多 |
| C、常温下,CO的燃烧热为566.0 kJ/mol |
| D、人类利用的能源都是通过化学反应获得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成CO2、H2O(气)、N2.在相同条件下它们的体积比为12:8:1,则a:b为( )
和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成CO2、H2O(气)、N2.在相同条件下它们的体积比为12:8:1,则a:b为( )| A、1:1 | B、1:2 |
| C、2:3 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此反应可在瞬间产生大量高温气体,推动火箭飞行 |
| B、此反应是氧化还原反应,N2O4是氧化剂 |
| C、每生成1mol N2,该反应转移电子8mol |
| D、此反应中R的分子式为C2H8N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com