
【题目】元素是构成我们生活的世界中一切物质的“原材料”。
Ⅰ.1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
Ni=Co=59 | |||||
H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
C=12 | Si=28 | ?=70 | Sn=118 | ||
N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
O=16 | S=32 | Se=79.4 | Te=128? | ||
F=19 | Cl=35.5 | Br=80 | I=127 | ||
Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
Ca=40 | Pb=207 |
(1)门捷列夫将已有元素按照相对原子质量排序,同一_____(填“横行”或“纵列”)元素性质相似。
(2)结合表中信息,猜想第5列方框中“Te=128?”的问号表达的含义是___________。
Ⅱ.X、Y、Z、W是现在元素周期表中的短周期元素,它们的相对位置如下图所示,其中 Y 元素原子核外最外层电子数是其电子层数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中的位置____________________。
(2)比较Y、Z气态氢化物的稳定性______________(用分子式表示)。
(3)科学家们认为存在含氢量最高的化合物XH5,预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___________,XH5是离子化合物,它的电子式为________。
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式_______________________________。
【答案】 横行 怀疑Te的相对原子质量(或同一列相对原子质量依次增大,按此规律,Te的相对原子质量应该在122和127之间) 第三周期第ⅦA族 H2S<H2O NH5+H2O=H2↑+NH3·H2O  2S2Cl2+2H2O═3S↓+SO2↑+4HCl
2S2Cl2+2H2O═3S↓+SO2↑+4HCl
【解析】Ⅰ.(1) 结合表中信息得,给出的是元素的相对原子质量,故同一横行元素性质相似;(2)结合表中信息,猜想第5列方框中“Te=128?”的问号表达的含义是怀疑Te的相对原子质量(或同一列相对原子质量依次增大,按此规律,Te的相对原子质量应该在122和127之间);Ⅱ.在短周期元素中,Y 元素原子核外最外层电子数是其电子层数的3倍,则Y是8号的O元素,根据元素在周期表中的相对位置关系可确定:X是N元素,Y是O元素;Z是S元素,W是Cl元素。(1)W是Cl元素,位于周期表中的位置第三周期第ⅦA族;(2)同主族从上而下非金属性减弱,气态氢化物的稳定性减弱,故Y、Z气态氢化物的稳定性H2S<H2O;(3) X是N元素,科学家们认为存在含氢量最高的化合物XH5,即NH5,预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,该反应的化学方程式为NH5+H2O=H2↑+NH3·H2O,XH5是离子化合物,它的电子式为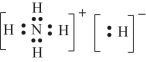 ;(4)化合物S2Cl2可与水反应生成一种能使品红溶液褪色的气体,该气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl。
;(4)化合物S2Cl2可与水反应生成一种能使品红溶液褪色的气体,该气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 分子中共价键键能越高,键长越长,则分子越稳定
B. 元素周期表中的ⅡA族和ⅦA族元素的原子间不能形成共价键
C. 水分子可表示为H—O—H,分子中键角为180°
D. N—N、N===N、N≡N键能之比为1.00:2.17:4.90,说明N2分子中π键键能>σ键键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行实验能达到相应实验目的的是
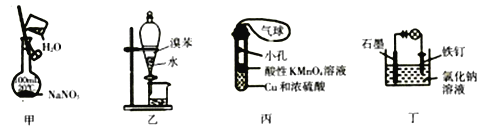
A. 用甲装置配制一定物质的量浓度的NaNO3溶液
B. 用乙装置分离溴苯和水
C. 用丙装置制取SO2气体并验证其还原性(可加热)
D. 用丁装置防止铁钉生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成。现取3 g A与 4.48 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6 g,碱石灰增重4.4 g。回答下列问题:
(1)通过计算确定该有机物的分子式___________________。
(2)若有机物A能与金属钠反应放出氢气,请写出有机物A可能的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是H2S和SO2)的转化具有重要意义。
(1)H2S资源化利用途径之一是回收能量并得到单质硫,如图为质子膜H2S燃料电池的示意图。
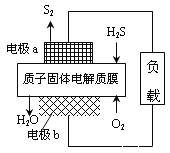
①电极a为电池的_______极,电极b上发生的电极反应为:______________________。
②每17gH2S参与反应,有_____molH+经质子膜进入_____极区。
(2)低浓度SO2废气的处理是工业难题,目前常用的方法如下:
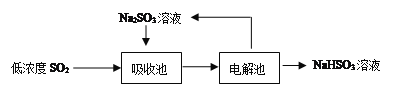
①Na2SO3溶液吸收SO2的化学方程式是____________________________________。
②如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是(____)
A.Na2SO3B.Na2S C.Ba(NO3)2 D.酸性KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定体积、一定物质的量浓度的溶液,实验结果产生偏高影响的是( )
A.容量瓶中原有少量蒸馏水
B.溶解所用的烧杯未洗涤
C.称量时左码右物
D.定容时俯视观察液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)H2O(g)+CO(g)的平衡常数K= ![]() .该温度下在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是( )
.该温度下在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是( )
起始量 | 甲 | 乙 | 丙 |
H2 (mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2)是0.08 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于离子反应的是
A.氢气还原氧化铜生成水和铜
B.石灰石高温分解生成氧化钙和二氧化碳
C.盐酸滴加到石灰石固体上
D.实验室加热高锰酸钾制氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A.一定有氧元素参加
B.氧化反应一定先于还原反应发生
C.氧化剂本身发生氧化反应
D.一定有电子转移(得失或偏移)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com