
【题目】将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。完成下列填空:
(1)写出一个包含上述七种物质的氧化还原反应方程式,配平并标出电子转移方向和数目:___________________________。
(2)上述反应中,氧化剂是_____________,每转移1 mol电子,生成Cl2_____ L(标准状况)。
(3)在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。写出该实验中涉及反应的离子反应方程式:_________________。
(4)根据以上实验,写出两个反应中氧化剂、氧化产物的氧化性强弱顺序__________。
(5)上述氧化还原反应体系中,属于第三周期元素的简单离子半径由大到小的顺序为________
(6)氯原子的最外层电子的轨道式为___________,氯原子核外有_______不同运动状态的电子。
【答案】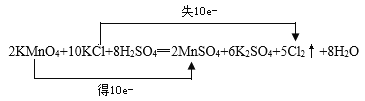 KMnO4 11.2 2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O NaBiO3>KMnO4>Cl2 S2->Cl-
KMnO4 11.2 2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O NaBiO3>KMnO4>Cl2 S2->Cl-  17
17
【解析】
(1)由浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中Cl元素的化合价升高,则氧化反应为KCl→Cl2,然后根据元素守恒来书写氧化还原反应;
(2)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,根据氧化剂和转移电子之间的关系计算;
(3)在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,说明Mn2+被氧化变为MnO4-,BiO3-发生反应得到电子后变为无色的Bi3+,据此写出离子方程式;
(4)在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(5)上述氧化还原反应体系中,属于第三周期元素有S、Cl,根据离子半径大小比较方法判断;
(6)根据构造原理可知氯原子的核外电子排布式,任何一个原子核外没有运动状态完全相同的电子存在;结合原子尽可能成单排列,而且自旋方向相同书写Cl原子最外层电子的轨道式。
(1)由题意可知,高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中Cl元素的化合价升高,则氧化反应为KCl→Cl2,则反应为KMnO4+KCl+H2SO4→MnSO4+K2SO4+Cl2↑+H2O,由电子守恒及原子守恒可得配平后的化学反应为 ;
;
(2)2KMnO4+10KCl+8H2SO4=2MnSO4+6K2SO4+5Cl2↑+8H2O中,锰元素的化合价由+7变为+2,所以高锰酸钾是氧化剂,2 mol氧化剂在反应中得到电子的物质的量=2 mol×(7-2)=10 mol,每转移1 mol电子,生成Cl2是0.5 mol,其在标准状况下的体积为V(Cl2)=0.5 mol×22.4 L/mol=11.2 L;
(3)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,是因NaBiO3具有强氧化性(比KMnO4氧化性强),将Mn2+氧化为MnO4-,BiO3-得到电子被还原变为无色的Bi3+,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为:2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O;
(4)在反应2KMnO4+10KCl+8H2SO4=2MnSO4+6K2SO4+5Cl2↑+8H2O中,物质的氧化性:KMnO4>Cl2;在反应2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O中,物质的氧化性:NaBiO3>KMnO4,所以氧化性强弱顺序是:NaBiO3>KMnO4>Cl2;
(5)上述氧化还原反应体系中,属于第三周期元素有硫和氯,S2-、Cl-核外电子排布都是2、8、8,电子层结构相同,由于核电荷数Cl>S,核电荷数越大,离子的半径就越小,所以其简单离子半径:S2->Cl-;
(6)Cl是17号元素,核外电子排布式是1s22s22p63s23p5,可见Cl原子最外层有7个电子,氯原子的最外层电子的轨道式为 ,氯原子核外有17不同运动状态的电子。
,氯原子核外有17不同运动状态的电子。


科目:高中化学 来源: 题型:
【题目】请根据以下知识解答
![]() +R2-CHO →
+R2-CHO →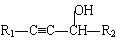 (R代表烃基,下同。)
(R代表烃基,下同。)
![]() +H2
+H2![]()
![]()
1,4―丁二醇是生产工程塑料PBT(聚对苯二甲酸丁二酯)的重要原料,它可以通过下图两种不同的合成路线制备,请写出相应物质的结构简式
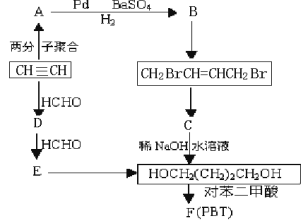
(1)请写出A和D的结构简式:________________________、_____________________。
(2)写出生成CH2BrCH=CHCH2Br的化学反应方程式:______写出生成F (PBT)的化学反应方程式:___。
(3)关于对苯二甲酸的结构,在同一直线上的原子最多有________个。
(4)某学生研究发现由乙炔可制得乙二醇,请你设计出合理的反应流程图。________________
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代化学测定有机物组成及结构的分析方法较多。下列有关说法正确的是
A.元素分析仪不仅可以测出试样常见的组成元素及含量,还可以测定其分子的空间结构
B.![]()
C.通过红外线光谱图分析可以区分乙醇和乙酸乙酯
D.质谱法和紫外光谱法不属于测定有机物组成和结构的现代分析方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的二元弱酸,还是一种重要的还原剂。草酸及草酸盐在工农业生产及科学研究领域均有广泛应用。利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。方法如下:抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸,再用已知浓度的酸性KMnO4溶液滴定,使草酸转化成CO2逸出,根据消耗的KMnO4溶液的体积即可测定血液样品中Ca2+的浓度。
(1)写出草酸与酸性KMnO4溶液反应的离子方程式______________________________________ 。
(2)抽取血样10.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.010mol/L KMnO4溶液滴定,确定反应达到终点的现象是_______________________________________________________。
(3)滴定结束共消耗12.00mL KMnO4溶液。则血液样品中Ca2+离子的浓度为______mg/mL。
(4)下列操作可能使所测定结果偏高的是_________。
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气产生NO的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是
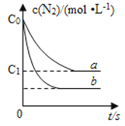
A.曲线b对应的条件改变可能是加入了催化剂
B.温度T下,随着反应的进行,混合气体的密度减小
C.温度T下,该反应的平衡常数K =
D.若曲线b对应的条件改变是温度,可判断该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。某研究小组设计制备SnSO4与SnCl4路线如下。完成下列填空:
(一)制备SnSO4
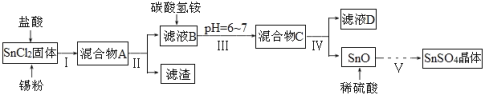
已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
(1)SnCl2用盐酸进行酸溶的原因是_____________________。
(2)步骤Ⅱ中用到的玻璃仪器除烧杯外还有____________;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为______________。
(3)步骤Ⅴ依次操作:蒸发浓缩、_________、_________、洗涤、低温干燥,即可得到产物。
(二)制备SnCl4
实验室用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。实验装置如图所示:

(4)仪器B的名称______________。
(5)图中尾气处理装置不够完善,改进的方法是:________________(可以画图,也可以用文字表述,需注明仪器、试剂及连接位置等)。
(6)若反应中用去锡粉11.9 g,反应后在锥形瓶中收集到23.8 g SnCl4,则SnCl4的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可表示为FeOCr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
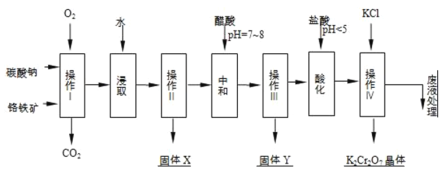
已知:
①4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是______.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有______(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是______.(离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、______、______、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是______.(文字说明)
物质 | 溶解度/(g/100g水) | ||||
0°C | 40°C | 80°C | |||
KCl | 28 | 40.1 | 51.3 | ||
NaCl | 35.7 | 36.4 | 38 | ||
K2Cr2O7 | 4.7 | 26.3 | 73 | ||
Na2Cr2O7 | 163 | 215 | 376 | ||
(6)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为______(用含m、n的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图。关于该有机物的叙述中正确的是

① 在Ni催化条件下1mol该有机物可与3mol H2发生加成;
② 该有机物不能发生银镜反应;
③ 该有机物分子式为C12H22O2;
④ 该有机物的同分异构体中不可能有酚类;
⑤ 1 mol该有机物水解时只能消耗1 mol NaOH
A. ②③④ B. ①④⑤ C. ②④⑤ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是_________;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体__________克;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应;
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是___________,其物质的量之比是_____________;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68克.经分析,原溶液中的Cu2+有20%残留在母液中.求所得晶体的化学式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com