
【题目】铜是人类最早使用的金属之一。也是中学中常见的过镀金属元素。铜是与人类关系非常密切的有色金属。被广泛地作力导线应用于电气、轻工、机械制造、建筑工业、国防工业等领域在中国有色金属材料的消费中仅次于铝。回答下列问题:
(1)基态Cu+原子核外电子排式为___。
(2)CuCl晶体的晶格能可通过如图的Born-Haber循环计算得到:
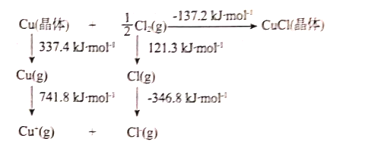
铜原子的第一电离能为___kJmol-1;Cl-Cl键键能为___kJmol-1;CuCl的晶格能为___kJmol-1。
(3)铜盐属于重金属盐,铜盐中毒可用青霉胺解毒,解毒原理如下:Cu2+能与青霉胺成环状络合物,该环状络合物无毒、易溶于水,可经尿液排出。

①青霉胺分子中S原子的轨道杂化类型为___;
②硫化氢与氨气键角的大小:H2S___NH3(填“>”或“<”)。
③第二周期元素中,第一电离能大于N的元素有___(用元素符号表示)。
④该环状络合物无毒、易溶于水,可经尿液排出,请解释该化合物易溶于水的主要原因:___。
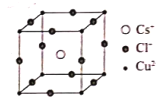
(4)某含铜的离子化合物M由Cs、Cu、Cl三种元素构成,M属于立方体晶系的离子晶体,其结构如图所示。试回答下列问题:
①离子化合物M的化学式为___;
②已知Cs和Cl两元素离子的半径大小相近,该晶体中两种离子联合组成何种形式的密堆积___;
③若晶胞参数为anm,则这种晶体密度为___gcm-3(用含a、和NA的式子表示)。
【答案】1s22s22p63s23p63d10或[Ar]3d10 741.8 242.6 990.9 sp3 < F、Ne 该化合物与水之间可以形成分子间氢键 CsCuCl3 面心立方最密堆积 ![]()
【解析】
(1)Cu为29号元素,失去最外层1个电子形成Cu+,根据核外电子的排布规律,基态Cu+的电子排布式是1s22s22p63s23p63d10或[Ar]3d10;
(2)据图可知1mol气态铜原子各失去一个电子形成气态Cu+所需要的能量为741.8kJ/mol,所以铜原子的第一电离能为741.8 kJ/mol;0.5mol氯气吸收 121.3 kJ/mol能量变为气态氯原子,即断裂0.5molCl-Cl键需要吸收121.3 kJ/mol,所以Cl-Cl键键能为242.6 kJ/mol;据图可知:Cu(晶体)+![]() Cl2(g)→CuCl(晶体)△H=-137.2 kJ/mol;
Cl2(g)→CuCl(晶体)△H=-137.2 kJ/mol;
Cu(晶体)→Cu+(g)△H1=+337.4 kJ/mol+741.8 kJ/mol;
![]() Cl2(g)→Cl-(g)△H2=+121.3kJ/mol-346.8kJ/mol;
Cl2(g)→Cl-(g)△H2=+121.3kJ/mol-346.8kJ/mol;
根据盖斯定律CuCl(晶体)→Cu+(g)+ Cl-(g)△H3=△H1+△H2-△H =990.9kJ/mol,所以CuCl的晶格能为990.9 kJ/mol;
(3)①图示结构中S原子形成2个共价单键,1个配位键,还有1对孤电子对,所以价层电子对数为4,为sp3杂化;
②氨分子只有一对孤对电子,排斥力比有两对孤对电子的硫化氢小,所以键角比硫化氢大;
③同周期元素自左至右第一电离能呈增大趋势,但由于N原子最外层为半满状态,第一电离能大于相邻的O元素,所以第二周期中第一电离能大于N的有F、Ne;
④该化合物容易与水分子之间形成分子间氢键,提高其在水中的溶解度;
(4)①根据均摊法,该晶胞中Cs+的个数为1,Cl-的个数为![]() =3,Cu2+的个数为
=3,Cu2+的个数为![]() =1,所以该离子化合物的化学式为CsCuCl3;
=1,所以该离子化合物的化学式为CsCuCl3;
②该晶胞中Cs+占据体心,Cl-占据棱心,离子的半径大小相近,联合组成面心立方最密堆积;
③晶胞的质量m=![]() g,晶胞的体积V=a3nm3,所以晶胞的密度为
g,晶胞的体积V=a3nm3,所以晶胞的密度为 =
=![]() g·nm3=
g·nm3=![]() g·cm3
g·cm3


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】已知浓硫酸和木炭粉在加热条件下可发生化学反应。
(1)上述反应的化学方程式为_____________________
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。

这些装置的连接顺序(按产物气流从左至右的方向)是(填装置中导管口的编号):
_________接__________ ,________接__________,___________ 接_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W在医药和新材料等领域有广泛应用,其合成路线如图所示:

已知以下信息:
①1molY完全反应生成2molZ,且在加热条件下Z不能和新制的氢氧化铜反应
② +R1COOH
+R1COOH
③R1CH2NH2 +H2O(R1、R2、R3代表烃基)
+H2O(R1、R2、R3代表烃基)
回答下列问题:
(1)Y的化学名称是___________,Z中的官能团名称是___________。
(2) 中___________(填“有”或“无”)手性碳原子,①的反应类型是___________。
中___________(填“有”或“无”)手性碳原子,①的反应类型是___________。
(3)反应③所需的试剂和条件是___________。
(4)反应⑤的化学方程式为___________。
(5)G是对硝基乙苯的同分异构体,G能和碳酸氢钠反应产生气体且分子中含有氨基(-NH2),G的可能结构共有___________种(不考虑立体结构);其中核磁共振氢谱为五组峰,峰面积比为2:2:2:2:1的结构简式为___________。
(6)已知氨基(-NH2)易被酸性KMnO4溶液氧化。设计由甲苯和丙酮为原料制备药物中间体![]() 的合成路线:___________(无机试剂任选)。
的合成路线:___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.透明的溶液中: Fe3+、Al3+、CO32-、SO42-
C.![]() =1012的溶液中:Na+、Ba2+、Cl-、AlO2-
=1012的溶液中:Na+、Ba2+、Cl-、AlO2-
D.c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于氯酸钠(NaClO3)具有吸湿性,不易保存,因此工业上常采用电渗析法将氯酸钠(NaClO3)转化成氯酸钾(KClO3),其工作原理如图所示(a、b两电极均为石墨电极,c、d、e依次为阳离子交换膜、阴离子交换膜、阳离子交换膜),下列法说不正确的是( )
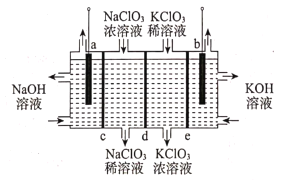
A.a电极连接电源负极
B.左池NaOH溶液出口浓度大于入口浓度
C.该电解池的工作原理实质是电解水
D.制备1molKClO3,a、b两极共产生16.8L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa;②0.1mol·L-1NaClO;③0.1mol·L-1Na2CO3;④0.1mol·L-1NaHCO3四种溶液的pH由大到小的关系为________________。(用序号填空)
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-=10-ymol·L-1,x与y的关系如图所示。

①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_______。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按甲方式混合后,所得溶液的pH为____________;
按乙方式混合后,其反应的离子方程式:_________________。
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.NaHS的水解:HS-+ H2O![]() S2-+ H3O+
S2-+ H3O+
B.NaHCO3在水溶液中的电离:HCO3+ H2O![]() H2 CO3+ OH
H2 CO3+ OH
C.NH4Cl的水解:NH4+ + H2O = NH3·H2O + OH
D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着5G时代的到来,半导体材料将迎来快速发展,三氯化氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室利用PCl3、SO2、Cl2在60~65°C时反应制备POCl3和SOCl3的实验装置如图所示(气体的制备装置未画出)。
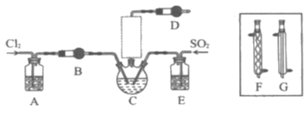
资料卡片:
物质 | 熔点/°C | 沸点/°C | 其他 |
PCl3 | -93.6 | 76.1 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 遇水剧烈水解,能溶于PCl3 |
SOCl3 | -105 | 78.8 | 遇水剧烈水解,受热易分解 |
(1)该反应的化学方程式为___。
(2)A、B装置中的试剂分别是___、___。
(3)装置E的作用是___。
(4)反应装置的虚线框中未画出的仪器最好选用___(填“F”或“G”),理由是___。
(5)反应结束后,提纯POCl3的操作是___(填操作名称)。
(6)测定某掺杂剂中POCl3的含量(杂质不参与反应):准确称取4.000g样品在水解瓶中摇动至完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.4000molL-1的AgNO3溶液25.00mL,再加少许硝基苯,用力振荡。加入NH4Fe(SO4)2作指示剂,用0.l000molL-1KSCN标准溶液滴定过量的AgNO3至终点,消耗KSCN标准溶液22.00mL。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,Ag3PO4可溶于硝酸,POCl3的相对分子质量为153.5]
①加入少量的硝基苯的目的是___。
②POCl3的质量分数为___。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5mol·L-1 MgSO4溶液和0.5mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL三颈烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是_________。
②步骤3生成MgCO3·nH2O沉淀的化学方程式为__________。
③步骤4检验沉淀是否洗涤干净的方法是__________。
(2)测定生成的MgCO3·nH2O中的n值。
称量1.000碳酸镁晶须,放入如图所示的广口瓶中加入适量水,并滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后将烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
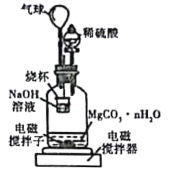
①图中气球的作用是_________。
②上述反应后期要升温到30℃,主要目的是______。
③测得每7.8000g碳酸镁晶须产生标准状况下CO2为1.12L,则n值为_______。
(3)碳酸镁晶须可由菱镁矿获得,为测定某菱镁矿(主要成分是碳酸镁,含少量碳酸亚铁、二氧化硅)中铁的含量,在实验室分别称取12.5g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,加入指示剂,用0.010mol/L H2O2溶液进行滴定。平行测定四组。消耗H2O2溶液的体积数据如表所示。
实验编号 | 1 | 2 | 3 | 4 |
消耗H2O2溶液体积/mL | 15.00 | 15.02 | 15.62 | 14.98 |
①H2O2溶液应装在_________(填“酸式”或“碱式”)滴定管中。
②根据表中数据,可计算出菱镁矿中铁元素的质量分数为_________ %(保留小数点后两位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com