
| A��B��Aֻ���γɻ�����BA3 |
| B��C��ԭ�Ӱ뾶�����Ӱ뾶���ֱ�С��D��ԭ�Ӱ뾶�����Ӱ뾶 |
| C��A��B��C�γɵĻ�������ܴٽ�ˮ�ĵ��룬Ҳ��������ˮ�ĵ��� |
| D��A��D������C�γ�ԭ�Ӹ�����Ϊ1��1��2��1�Ļ������A2C2��D2C2�Ļ�ѧ��������ͬ |


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
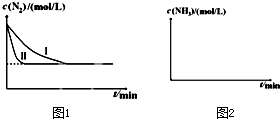
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�ش��� | X | Y | Z | R | T |
| ԭ�Ӱ뾶/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.066 |
| ��Ҫ���ϼ� | +1 | +2 | +3 | +6��-2 | -2 |
| A���⻯��ķе�ΪH2T��H2R |
| B��Y2+�İ뾶��T2-�İ뾶�� |
| C��Z2R3������ˮ��Һ�д��� |
| D��Ԫ��X��T�γɵĻ������в����ܺ��й��ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH=9��NH4Cl��NH3?H2O�����Һ��c��Cl-����c��NH4+�� |
| B��pH=2.5�Ŀ�����c��H+����pH=3.5������ˮ��c��H+����10�� |
| C��AgCl��0.1mol/L CaCl2��Һ��0.1mol/L NaCl��Һ�е��ܽ����ͬ |
| D��1mL 1mol?L-1 Na2CO3��Һ��ˮϡ����100mL��pH��Kw����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | ���� | �Լ� | ���� | |
| A | ���� | ��ϩ | ���Ը��������Һ | ϴ�� |
| B | �Ȼ�������Һ | �Ȼ��� | �������� | ���� |
| C | �������� | ������ | ����������Һ | ���� |
| D | �������� | ���� | ����̼������Һ | ���� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
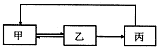 �±��и�������֮�䲻��ͨ��һ����Ӧʵ����ͼת�����ǣ�������
�±��и�������֮�䲻��ͨ��һ����Ӧʵ����ͼת�����ǣ�������| �� | �� | �� | |
| A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
| B | SiO2 | H2SiO3 | Na2SiO3 |
| C | Cl2 | HCl | CuCl2 |
| D | AlCl3 | Al��OH��3 | Al2O3 |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ȼ�Һ��ϴ���ı��������ʱ����������ð�� |
| B����⾫��ͭ������������ҺŨ�Ȳ��� |
| C��Fe2+��H+��NO3-���߲������ԭ��Ϊ��3Fe2++4H++NO3-�T3Fe3++NO��+2H2O |
| D��Ӳ��������Ϊ��Ҫ�Ͻ�Ԫ�صĺϽ���ϣ����۵���ڴ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����pH=1����Һ�У�K+��Na+��SO42-��HCO3- | ||
| B����0.1mol?L-1 Na2CO3��Һ�У�Al3+��K+��NO3-��SO42- | ||
| C����0.1mol?L-1 FeCl3��Һ�У�K+��NH4+��I-��SCN- | ||
D����
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������£�9g H2O�к�NA��O-H�� |
| B��1mol Fe2+������ϡ���ᷴӦ��ת��3NA������ |
| C�����³�ѹ�£�22.4L SO2��O2�Ļ�������к�2NA����ԭ�� |
| D��0.1mol?L-1 KAl��SO4��2��Һ�к�0.2NA��SO42- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com