
| A. | 工业上生产玻璃、水泥均需要用石灰石做原料 | |
| B. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、煤的干馏、海水晒盐、从菜籽中提取菜籽油等过程都是物理变化 |
分析 A.依据工业上生产玻璃、水泥用到的原料解答;
B.依据双氧水、高锰酸钾强氧化性,二氧化硫与有机色素化合生成无色物质的漂白原理解答;
C.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染;
D.有新物质生成的为化学变化,没有新物质生成的为物理变化.
解答 解:A.生产水泥以黏土和石灰石为主要原料,生产玻璃的原料是纯碱、石灰石和石英,均用到碳酸钙,故A正确;
B.双氧水、高锰酸钾溶液可以杀灭病毒是因为其具有强的氧化性,二氧化硫漂白丝织物是因为二氧化硫与有色物质化合生成无色物质,二者原理不同,故B错误;
C.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染,故C错误;
D.煤的干馏过程中有新物质生成属于化学变化,故D错误;
故选:A.
点评 本题主要考查化学物质与生活得关系、绿色化学的概念、物理变化与化学变化的判断,熟悉生产玻璃、水泥原料、明确过氧化氢、高锰酸钾、二氧化硫的性质,把握绿色化学的核心是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 | |
| B. | 被氧化和被还原的元素分别为铜和氮 | |
| C. | 当产生0.2 mol气体时,转移电子为0.6 mol | |
| D. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
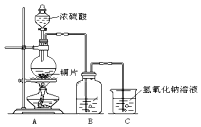 如图为足量铜与浓硫酸反应的装置.请回答:
如图为足量铜与浓硫酸反应的装置.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
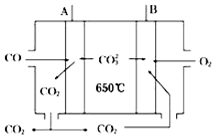 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
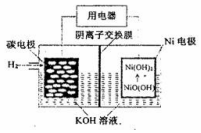
| A. | 放电时,OH-向碳电极迁移 | |
| B. | 放电时,负极反应NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| C. | 充电时,镍电极与电极的正极相连 | |
| D. | 充电时,碳电极区溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
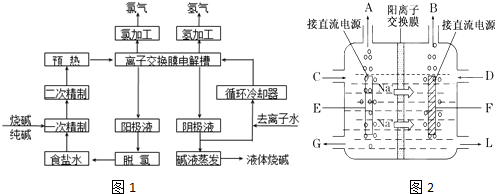
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.24 mol/(L•min) | B. | 0.08 mol/(L•min) | C. | 0.06 mol/(L•min) | D. | 0.12 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1L含24.5gH2SO4的溶液 | B. | 0.5L含49gH2SO4的溶液 | ||
| C. | 98gH2SO4溶于水配成2 L溶液 | D. | 1LH2SO4溶液中含98gH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3一四甲基丁烷 | B. | 2,3,4一三甲基戊烷 | ||
| C. | 3,4一二乙基己烷 | D. | 2,2一二甲基己烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com