
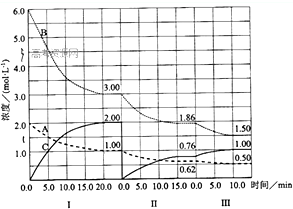
 反应aA(g)+bB(g)
反应aA(g)+bB(g)| 催化剂 |
| △c |
| △t |
| △c |
| △t |
| 3mol/L |
| 20min |
| 催化剂 |
| c2(C) |
| c(A)?c3(B) |
| 22 |
| 1×33 |
| 1mol/L |
| 20min |
| 1mol/L-0.62mol/L |
| 15min |
| 0.62mol/L-0.5mol/L |
| 10min |
| 3mol/L |
| 6mol/L |
| 3mol/L-1.86mol/L |
| 3mol/L |
| 1.86mol/L-1.5mol/L |
| 1.86mol/L |


科目:高中化学 来源: 题型:
A、 制取并收集乙炔 |
B、 比较NaHCO3、Na2HCO3的热稳定性 |
C、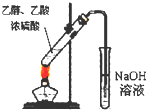 实验室中制取少量乙酸乙酯 |
D、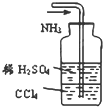 吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
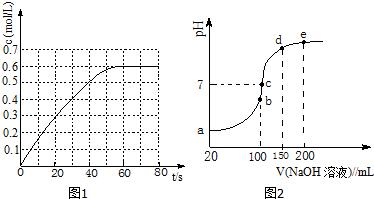
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4s内用物质B表示的反应速率为0.125mol?L-1?S-1 |
| B、达到平衡后若向容器中通入惰性气体,则A的转化率增大 |
| C、此时,A、B、C的物质的量之比为3:1:2 |
| D、达平衡后若升高温度,C的浓度将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| … | E | A | B | ||
| C | … | D |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①④ | C、③④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2、NH3、HCl |
| B、H3PO4、H2O、Cu |
| C、H2SO4、HNO3、BaCl2 |
| D、液态KNO3、NaOH溶液、乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com