
| A、用醋酸去除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||
B、甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2
| ||
C、实验室用液溴和苯在催化剂作用下制溴苯: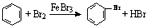 | ||
D、将CO2通入苯酚钠溶液: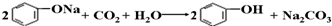 |
| △ |
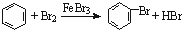 ,故C正确;
,故C正确;

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、HClO是弱酸,所以NaClO是弱电解质 |
| C、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D、杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ?mol-1 |
| B、稀醋酸与0.1 mol?L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1 |
| C、已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ?mol-1 |
| D、已知2C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1,则可知C的燃烧热△H=-110.5 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2CO3?2H++CO32- |
| B、NaHSO4(溶液)=Na++H++SO42- |
| C、NaHCO3=Na++HCO3- |
| D、Ba (OH)2=Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铁溶液加热蒸干最终得不到氯化铁固体 |
| B、镀锡的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 |
| C、电解精炼铜时,每转移2 mol电子阳极上溶解的铜原子数为NA |
| D、在lL0.lmol.L-1碳酸钠溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
| C、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- |
| D、NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ | ||||
B、电解饱和食盐水 2Cl-+2H+
| ||||
| C、在稀氨水中通入过量CO2 NH3?H2O+CO2=NH4++HCO3- | ||||
| D、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2═Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用标准盐酸滴定NaOH溶液,测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用标准盐酸滴定NaOH溶液,测定其浓度.| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.80 | 25.30 |
| 2 | V | |||
| 3 | V | 6.00 | 31.35 | 25.35 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com