
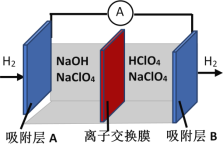
【题目】刚结束的两会《政府工作报告》首次写入“推动充电、加氢等设施的建设”。如图是一种正负电极反应均涉及氢气的新型“全氢电池”,能量效率可达80%。下列说法中错误的是
A. 该装置将化学能转换为电能
B. 离子交换膜允许H+和OH-通过
C. 负极为A,其电极反应式是H2-2e- + 2OH- = 2H2O
D. 电池的总反应为H+ + OH-![]() H2O
H2O
【答案】B
【解析】
由工作原理图可知,左边吸附层A上氢气失电子与氢氧根结合生成水,发生了氧化反应为负极,电极反应是H2-2e-+2OH-═2H2O,右边吸附层B为正极,发生了还原反应,电极反应是2H++2e-═H2↑,结合原电池原理分析解答。
A.“全氢电池”工作时是原电池反应,能量变化是将化学能转化为电能,故A正确;
B. 由工作原理图可知,左边溶液为碱性,右边溶液为酸性,所以离子交换膜可阻止左边的碱性溶液和右边的酸性溶液发生中和,因此该离子交换膜不能允许H+和OH-通过,故B错误;
C.根据氢气的进出方向可知,氢气在吸附层A上发生氧化反应,化合价由0价变成+1价,吸附层A为负极,电极反应为:H2-2e-+2OH-═2H2O,故C正确;
D.根据C的分析可知,右边吸附层B为正极,发生了还原反应,正极电极反应是2H++2e-═H2↑,左边吸附层A为负极,发生了氧化反应,电极反应是H2-2e-+2OH-═2H2O,因此总反应为:H++OH-![]() H2O,故D正确;
H2O,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】油脂是重要的营养物质.某天然油脂A可发生下列反应:
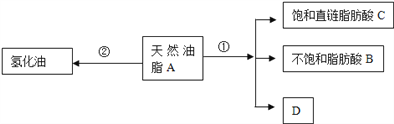
已知:A的分子式为C57H106O6.1mol该天然油脂A经反应①可得到1molD、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C.经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1;
(1)写出B的分子式:________________________;
(2)写出反应①的反应类型:____________;C的名称(或俗称)是_________;
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程.下列有关说法不正确的是_______________;
a.氢化油又称人造奶油,通常又叫硬化油.
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病.
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂.
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图:
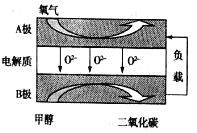
(1)B极为电池______极,B极的电极反应式为______________。
(2)该电池工作时,外电路每流过2mol e-,消耗标况下氧气__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,可通过KClO溶液与Fe(NO3)3溶液的反应制备。已知:①KClO在较高温度下发生歧化反应生成KClO3;
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
如图所示是实验室模拟工业制备KClO溶液装置。

(1)B装置的作用为___。
(2)反应时需将C装置置于冷水浴中,其原因为__。
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是__,制备K2FeO4的离子方程式:___。
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,溶液中可能含有Fe2+,检验Fe2+所需试剂名称___,其反应原理为___(用离子方程式表示)。
(5)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00gK2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,
装有Na2S2O3标准溶液的滴定管起始和终点读数如图所示:
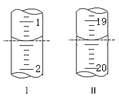
①消耗Na2S2O3标准溶液的体积为___mL。
②原样品中高铁酸钾的质量分数为__。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法错误的是( )
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法错误的是( )
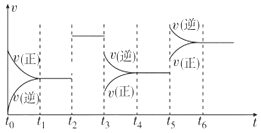
A.t2时加入了催化剂
B.t3时减小了压强
C.t5时升高了温度
D.t4~t5时间内X转化率最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的充放电反应为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。

(1)将A接E、B接F,B电极出现_____________现象,电极反应式为_____________,说明F为正极。
(2)铅蓄电池工作时(放电),E电极的反应式为_____________,充电时该极与外接电源的_____________极相连。
(3)若有0.2mol电子发生转移,则正极消耗PbO2的物质的量是______mol。
(4)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。

①若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现____色,铅笔芯c点处的电极反应式为________________。
②若用KI-淀粉溶液浸湿滤纸,用导线将a、b与铅蓄电池的E、F电极相连,铅笔芯c点处出现蓝色,则b接的是_______(填“E”或“F”)电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B。则符合上述条件的烃A有几种(考虑顺反异构)
已知:
A. 3 B. 4 C. 6 D. 8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①一种二肽的结构简式为: ,合成这种二肽的氨基酸是___和___;
,合成这种二肽的氨基酸是___和___;
②生活中有大量的铝制品。家用铝锅不能用热碱水洗涤去污,原因是(用离子方程式表示)____;
③大量使用塑料制品产生的污染称之为_____,防治该污染的有效措施之一是进行回收利用,将回收后的塑料进行____,可以获得乙烯、丙烯等化工原料;
④传统生产水泥的原料中除了石灰石、粘土外,还经常添加____,以调节水泥的硬化速度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化和液化是现代能源工业中重点考虑的综合利用技术。最常见的气化方法是用煤作原料生产水煤气,而比较流行的液化方法是煤在催化剂等条件下生产CH3OH。
已知制备甲醇的有关化学反应如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=-90.8 kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g)△H2=-412 kJmol-1
③CO(g)+2H2(g)CH3OH(g)△H3
I.回答下列问题:
(1)欲提高甲醇的产率,可以采取的措施有______(填字母序号)。
A.升高温度
B.增大压强
C.降低温度
D.降低压强
(2)提高甲醇反应选择性的关键因素是______。
(3)保持温度和容积不变,下列描述能说明反应③达到平衡状态的是______(填字母序号)。
A.v(CO):v(H2):v(CH3OH)=1:2:1
B.混合气体的压强不再随时间的变化而变化
C.单位时间内断裂2 mol H-H键,同时生成3mol C-H键
D.一段时间内的平均反应速率等于0
E.混合气体的平均摩尔质量保持不变
Ⅱ.在一密闭容器中投入1mol CO和2molH2发生反应③,实验测得平衡时甲醇的物质的量随温度、压强变化关系如图1所示:
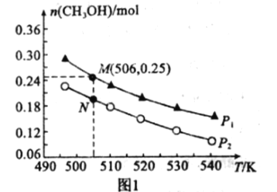
(1)压强P1______P2(填“>”、“<“或”=”)。
(2)M、N两点的化学反应速率:vM______vN(填“>”、“<“或“=”)
(3)对于气相反应,用某组分B的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数(Kp),则M点时,平衡常数Kp=______(P1=5 MPa)。
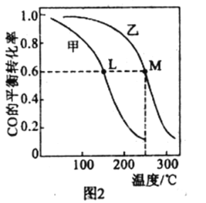
(4)甲、乙两个恒容密闭容器的体积相同,向甲中加入 1molCO和 2mol H2,向乙中加入2mol CO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)______2P(L),平衡常数:K(M)______K(L)(填“>”、“>”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com