
| A. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| B. | 常温下,1L0.1mol/LCH3COOH溶液中含有的H+数目为0.1NA | |
| C. | 25℃,PH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1L 1mol/L的NH4Cl溶液中,所含NH4+的数目小于NA |
分析 A、标况下四氯化碳为液态;
B、醋酸为弱电解质;
C、溶液体积不明确;
D、铵根离子为弱碱阳离子,在溶液中会水解.
解答 解:A、标准状况下,CCl4为液体物质,不是气体,故11.2LCCl4中含有的分子数目不为0.5NA,故A错误;
B、常温下,由于醋酸为弱酸,所以1L0.1mol/LCH3COOH溶液中含有的H+数目小于0.1NA,故B错误;
C、25℃,pH=13的NaOH溶液中含有OH-的数目无法确定,因为没有说明溶液体积,故C错误;
D、NH4Cl为强酸弱碱盐,所以1L 1mol/L的NH4Cl溶液中,所含NH4+的数目小于NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:实验题
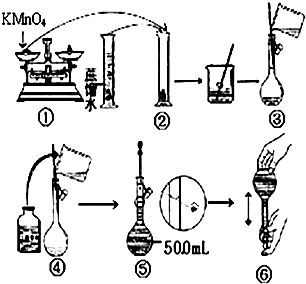 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaOH,溶液pH升高,c(SO32-)增大 | B. | 氯化钡有两性 | ||
| C. | 两支试管中的白色沉淀都是BaSO4 | D. | SO2具有两性且水溶液有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
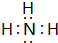 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
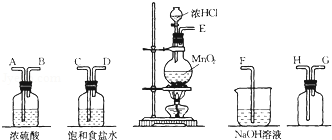
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com