
分析 (1)要求Z、n、b相同而A不同,在本题中只有同位素原子符合;
(2)要求Z不同而A、n、b相同,应该是质量数相同的不同元素的原子;
(3)n是微粒的电荷数,要求Z、A、b相同而n不同,应该是同一元素的不同价态的离子;
(4)b是原子个数,要求Z、n、A相同而b不同,应该是同素异形体.
解答 解:(1)Z、n、b相同而A不同,在本题中只有同位素原子符合,互为同位素,如:1H和2H,故答案为:1H和2H;
(2)Z不同而A、n、b相同,应该是质量数相同的不同元素的原子,如${\;}_{6}^{14}C$和${\;}_{7}^{14}N$,故答案为:${\;}_{6}^{14}C$和${\;}_{7}^{14}N$:
(3)Z、A、b相同而n不同,应该是同一元素的不同价态的离子,如Fe3+和Fe2+,故答案为:Fe3+和Fe2+;
(4)b是原子个数,要求Z、n、A相同而b不同,应该是同素异形体,如:O2和O3,故答案为:O2和O3.
点评 本题考查核素、同位素及其应用,涉及同素异形体、同一元素的不同离子的识别,注意①质量数A=质子数Z+中子数N②核外电子数=质子数=核电荷数=原子序数应用,综合性较强,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S | B. | Al2S3 | C. | FeS | D. | CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极,电极反应式:2H++2e-═H2↑ | |
| C. | 电解质溶液中,SO42-向正极方向移动 | |
| D. | 外电路电子流入的一极为正极,电子流出的一极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
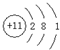 .C、D、E的简单离子半径由小到大的顺序Al3+<Na+<O2-( 用离子符号表示).
.C、D、E的简单离子半径由小到大的顺序Al3+<Na+<O2-( 用离子符号表示).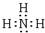 .检验该气体的常用方法是用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在.
.检验该气体的常用方法是用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA | |
| B. | 0.05 mol熔融的NaHSO4中含有的阳离子数为0.10NA | |
| C. | 11.2 L乙烯、乙炔的混合气体中含有的碳原子数为NA | |
| D. | 5.6 g Fe和足量盐酸完全反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g 46%的乙醇水溶液含有的氧原子数为0.4NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液1.0L,含有OH-数目0.2NA | |
| C. | 4.6g C2H6O含有的C-H键总数一定为0.5NA | |
| D. | 常温下,0.1mol Cl2溶于水转移的电子数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com