
| A. | 铅蓄电池充电时,阳极固体质量增大 | |
| B. | 0.1mol•L-1CH3COONa溶液加热后,溶液的pH减小 | |
| C. | 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023个 | |
| D. | 室温下,稀释0.1mol•L-1氨水c(H+).c(NH3•H2O)减小 |
分析 A.铅蓄电池充电时,阳极上电极反应式为PbSO4+2H2O-2e-═PbO2+4H++SO42-;
B.盐类水解反应是吸热反应,升高温度导致CH3COONa水解程度增大;
C.标况下,苯是液体,气体摩尔体积对其不适用;
D.室温下,稀释0.1mol•L-1氨水促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,所以溶液中c(OH-)、c(NH3•H2O)、c(NH4+)减小,温度不变,水的离子积常数、一水合氨电离平衡常数都不变.
解答 解:A.铅蓄电池充电时,阳极上电极反应式为PbSO4+2H2O-2e-═PbO2+4H++SO42-,所以阳极固体质量减小,故A错误;
B.盐类水解反应是吸热反应,升高温度导致CH3COONa水解程度增大,溶液的pH增大,故B错误;
C.标况下,苯是液体,气体摩尔体积对其不适用,所以无法计算碳原子个数,故C错误;
D.室温下,稀释0.1mol•L-1氨水促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,所以溶液中c(OH-)、c(NH3•H2O)、c(NH4+)减小,温度不变,水的离子积常数、一水合氨电离平衡常数都不变,c(H+).c(NH3•H2O)=$\frac{{K}_{w}}{c(O{H}^{-})}$.c(NH3•H2O)=$\frac{{K}_{w}.c(N{{H}_{4}}^{+}).c(N{H}_{3}.{H}_{2}O)}{c(O{H}^{-}).c(N{{H}_{4}}^{+})}$=$\frac{{K}_{w}.c(N{{H}_{4}}^{+})}{{K}_{b}}$,铵根离子浓度减小导致c(H+).c(NH3•H2O)减小,故D正确;
故选D.
点评 本题考查弱电解质的电离、盐类水解、电解原理等知识点,为高频考点,明确化学反应原理及气体摩尔体积适用范围是解本题关键,难点是电极反应式的书写及D选项中式子的变换,题目难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | Y的氢化物比R的氢化物稳定,沸点高 | |
| B. | 原子半径大小关系为:X>R>Z>Y>W | |
| C. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定含有甲烷 | B. | 混合气体中一定含有乙烯 | ||
| C. | 混合气体中一定不含有乙炔 | D. | 混合气体中一定含有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
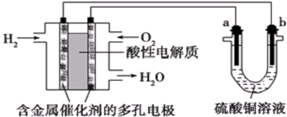
| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-=4OH- | |
| B. | a极是铁,b极是铜时,铁片表面会镀上一层红色的铜 | |
| C. | a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 | |
| D. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
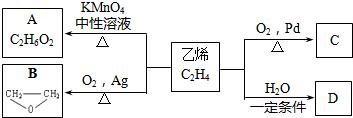
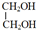 +2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
+2CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解后溶液质量减少(m+36)g | |
| B. | 原溶液中Na2SO4的质量分数为$\frac{71m}{161(m+18)}$ | |
| C. | 若其它条件不变,将石墨电极替换为铜电极,则阴极析出2mol H2 | |
| D. | 若其它条件不变,将石墨电极替换为铜电极,则析出Na2SO4•10H2O晶体仍为m g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ④ | |||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
 .②形成的最高价氧化物的结构式O=C=C.
.②形成的最高价氧化物的结构式O=C=C.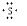 +
+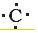 +
+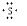 →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- | |
| C. | 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| D. | 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com