
| A、只是被氧化 |
| B、只是被还原 |
| C、既被氧化又被还原 |
| D、以上都不是 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊不消失. | NaAlO2溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失. | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去. | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊. | Ca(OH)2溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
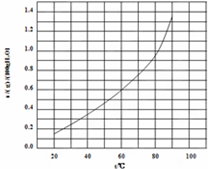
| A、溴酸银的溶解是放热过程 |
| B、温度升高时溴酸银溶解速度加快 |
| C、60℃时溴酸银的KSP约等于6.25×10-4 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在化学反应中,只有能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图1然后回答问题.
在化学反应中,只有能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图1然后回答问题.| 化学键 | H-S | S-S | S=O | H-O |
| 键能/KJ?mol-1 | 364 | 266 | 522 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通过甲烷的电极X为电池的负极,通过氧气的电极Y为电池正极 |
| B、放电一段时间后,电解质溶液中KOH的物质的量改变 |
| C、在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移 |
| D、放电时,通过甲烷的一极附近的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,22.4LCO2中含有NA个CO2分子 |
| B、1.7 gH2O2中含有电子数为0.9NA |
| C、标准状况下,2.24LH2O含有的分子数等于0.1NA |
| D、分子总数为NA的CO和C2H4混合气体体积约为22.4L则质量为28g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com