
【题目】(14分)近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是_________(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________、______________,制得等量H2所需能量较少的是_____________。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 k时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 k时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率![]() =_______%,反应平衡常数K=________。
=_______%,反应平衡常数K=________。
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率![]() _____
_____![]() ,该反应的
,该反应的![]() H_____0。(填“>”“<”或“=”)
H_____0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)
A.H2S B.CO2 C.COS D.N2
【答案】(1)D
(2)H2O(l)=H2(g)+![]() O2(g) ΔH=+286 kJ/mol H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol 系统(II)
O2(g) ΔH=+286 kJ/mol H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol 系统(II)
(3)①2.5 2.8×10-3 ②> > ③B
【解析】(1)A.根据复分解反应的规律:强酸+弱酸盐=强酸盐+弱酸,可知酸性H2SO3>H2CO3>H2S,A错误;B.亚硫酸、氢卤酸都是二元弱酸,由于溶液中离子浓度越大,溶液的导电性就越强,所以等浓度的亚硫酸的导电性比氢硫酸的强,可以证明酸性:H2SO3> H2S,B错误;C.等浓度的二元弱酸,酸电离产生的c(H+)越大,溶液的酸性越强,则其pH就越小。所以亚硫酸溶液的pH比等浓度的氢硫酸的小,可以证明酸性:H2SO3> H2S,C错误;D.物质的还原性大小与微粒中元素的化合价及微粒结构有关,与其电离产生氢离子的浓度大小无关,因此不能证明二者的酸性强弱,D正确。答案选D。
(2)①H2SO4(aq)=SO2(g)+H2O(l)+![]() O2(g) △H1=+327kJ/mol
O2(g) △H1=+327kJ/mol
②SO2(g)+I2(s)+ 2H2O(l)=2HI(aq)+ H2SO4(aq) △H2=-151kJ/mol
③2HI(aq)= H2 (g)+ I2(s) △H3=+110kJ/mol
④H2S(g)+ H2SO4(aq)=S(s)+SO2(g)+ 2H2O(l) △H4=+61kJ/mol
①+②+③,整理可得系统(I)的热化学方程式H2O(l)=H2(g)+![]() O2(g) △H=+286kJ/mol;
O2(g) △H=+286kJ/mol;
②+③+④,整理可得系统(II)的热化学方程式H2S (g)+ =H2(g)+S(s) △H=+20kJ/mol。
根据系统I、系统II的热化学方程式可知:每反应产生1mol氢气,后者吸收的热量比前者少,所以制取等量的H2所需能量较少的是系统II。
(3)① H2S(g) + CO2(g)![]() COS(g)+ H2O(g)
COS(g)+ H2O(g)
开始 0.40mol 0.10mol 0 0
反应 x x x x
平衡 (0.40-x)mol (0.10-x)mol x x
![]()
解得x=0.01mol,所以H2S的转化率是![]()
由于该反应是反应前后气体体积相等的反应,所以在该条件下反应达到平衡时化学平衡常数![]() ;
;
②根据题目提供的数据可知温度由610K升高到620K时,化学反应达到平衡,水的物质的量分数由0.02变为0.03,所以H2S的转化率增大。a2>a1;根据题意可知:升高温度,化学平衡向正反应方向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应,故△H>0;③A.增大H2S的浓度,平衡正向移动,但加入量远远大于平衡移动转化消耗量,所以H2S转化率降低,A错误;B.增大CO2的浓度,平衡正向移动,使更多的H2S反应,所以H2S转化率增大,B正确;C.COS是生成物,增大生成物的浓度,平衡逆向移动,H2S转化率降低,C错误;D.N2是与反应体系无关的气体,充入N2,不能使化学平衡发生移动,所以对H2S转化率无影响,D错误。答案选B。


科目:高中化学 来源: 题型:
【题目】下列做法不能减少大气污染的是
A.大力发展清洁能源,烟气脱硫B.大力发展私家车,减少公共交通
C.利用太阳能、风能等替代化石能源D.多使用电动车和自行车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是
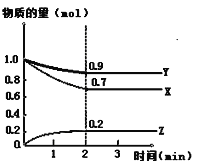
A. 用X表示该化学反应速率比用Y表示的要快
B. 该反应的化学方程式:3X+Y![]() 2Z
2Z
C. 若在3min后,把Z从反应体系中分离,平衡不移动
D. 反应开始至2min,Z的平均反应速率:0.1mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
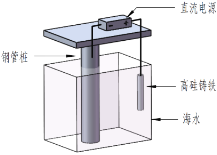
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成氨采用500℃左右的温度,其原因是:①适当加快NH3的合成速率 ②提高氢气的转化率 ③提高氨的产率 ④催化剂在500℃左右活性最好
A.①B.①③C.①④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应原理为2SnO2 + 3C![]() 2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
A. 反应中SnO2被还原 B. a的值为3
C. 反应后有两种氧化产物 D. 每生成1 mol CO2转移电子8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为: ____________________________,
Y元素原子最外层电子的电子排布图为:____________________________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为____(填“共价键”或“离子键”)。
(3)该化合物的空间结构为____,中心原子的杂化类型为____,分子为____(填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____。
(5)该化合物的沸点与SiCl4比较:____(填化学式)的高,原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com