
| A. | 利用化学知识和化学规律,人们可以更好的开发和利用资源 | |
| B. | 人们在开发和利用资源的过程中,对环境造成了污染,化学对此无能为力 | |
| C. | 利用化学知识和化学规律,人们可以制取更多物质,丰富物质世界 | |
| D. | 人们对资源的开发和利用过程中,时刻不能忘记资源的可持续性发展 |
分析 根据化学知识和化学规律,人们可以更好地开发和利用资源,人们可以制取更多物质,丰富物质世界,对资源的开发和利用过程中,时刻不能忘记资源的可持续性发展,对环境造成的污染,用化学方法使其得到有效治理.
解答 解:A.利用化学知识和化学规律,可以更好地开发和利用资源,如开发可燃冰,故A正确;
B.对环境造成的污染,用化学方法可以有效治理,如污水治理,故B错误;
C.利用化学知识和化学规律,可以制取更多的物质,如合成塑料和合成纤维,故C正确;
D.对资源的开发和利用过程中,时刻不能忘记资源的可持续性发展,如开发新能源,减少化石燃料的使用,故D正确.
故选B.
点评 本题主要考查自然资源的合理开发和综合利用以及环境污染方面的知识,题目难度不大,侧重于考查学生对基础知识的综合应用能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液在电流作用下电离成Na+与Cl- | |
| B. | 溶于水后能电离出H+的化合物都是酸 | |
| C. | 氯化氢溶于水能导电,但液态氯化氢不能导电 | |
| D. | NaCl固体不导电是由于不含Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是元素周期表的一部分,表格中所示元素均为前四周期的元素.X元素的非金属性在同周期中仅次于一种元素.下列说法中不正确的是( )
如图是元素周期表的一部分,表格中所示元素均为前四周期的元素.X元素的非金属性在同周期中仅次于一种元素.下列说法中不正确的是( )| A. | X代表的元素处于第ⅥA族 | |
| B. | Y的最低负化合价是-3 | |
| C. | M元素的最高价氧化物对应的水化物的化学式是HMO3 | |
| D. | 气态氢化物的稳定性:N>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浓氨水中滴加饱和 FeCl3溶液,可以制得 Fe(OH)3胶体 | |
| B. | 为除去Mg(OH)2固体中少量Ca(OH)2,可用饱和 MgCl2溶液多次洗涤,再水洗、干燥 | |
| C. | 向溶液X中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉 淀,说明溶液 X 中含有 CO32- | |
| D. | 卤代烃Y与NaOH醇溶液共热后,恢复至室温,再滴加AgNO3溶液,产生白色沉淀,说明卤代烃 Y 中含有氯原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

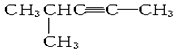 分子式为C5H8,名称是4-甲基-1-戊炔,
分子式为C5H8,名称是4-甲基-1-戊炔,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将食物存放在温度低的地方 | |
| B. | 将块状固体药品研细后再反应 | |
| C. | 用MnO2作H2O2分解反应的催化剂 | |
| D. | 用4 mol/LH2SO4溶液代替1 mol/LH2SO4溶液与锌粒反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com