
对于可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0,下列研究结果和示意图相符的是( )
| A | B | C | D | |
| 研究 结果 | 压强对反应的影响 | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
| A. | A | B. | B | C. | C | D. | D |
| 化学平衡建立的过程;化学平衡的影响因素.. | |
| 专题: | 化学平衡专题. |
| 分析: | 由于该反应的正反应是体积减小的放热反应,所以增加压强平衡向正反应的方向移动;升高温度平衡向逆反应方向移动;增加反应物浓度平衡向正反应方向移动;催化剂对化学平衡的移动没有影响,但可以提高反应速率,据此判断. |
| 解答: | 解:A、根据先拐先平的原理,图中P2大于P1,而此时P2对应的氨气的体积分数小于P1,说明平衡逆向移动,与平衡移动原理相矛盾,故A错误; B、该反应为放热反应,升高温度,平衡逆向移动,氮的转化率下降,故B错误; C、增加氮气,反应物浓度增大,正反应速率增大,逆反应速率在开始的瞬间不变,平衡正向移动,故C正确; D、有催化剂反应速率变快,反应到达平衡的时间变短,故D错误; 故选C. |
| 点评: | 本题主要考查了影响平衡移动的因素,中等难度,解题时不注意对图象的观察,理清各个物理量的变化关系. |


科目:高中化学 来源: 题型:
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
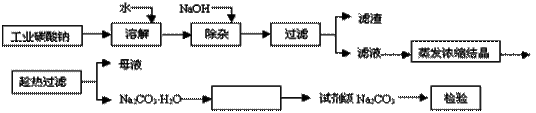
已知碳酸钠的溶解度(S)随温度变化的曲线如图所示:

回答下列问题:
(1)滤渣的主要成分为_________________________。
(2)“趁热过滤”的原因是______________________。
(3)在实验室做Na2CO3·H2O脱水实验,判断其脱水完全的方法是:__________。
(4)生产过程中“母液”____(填“能”或“不能”)循环使用。若不能,其原因是:_________。
(5)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g);ΔH1= +532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g);ΔH2= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
溴化钙在医药上用作中枢神经抑制药,实验室用“尿素法”制备溴化钙的主要流程如下:

溴化钙的部分溶解度数值如下:
| 温度 | 0℃ | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 溶解度(g) | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
(1)6Ca(OH)2+6Br2 50~70℃ 5CaBr2+6H2O+Ca(BrO3)2,每生成1 mol Ca(BrO3)2转移电子的物质的量为 ;50~70℃时,尿素[CO(NH2)2]将生成的Ca(BrO3)2还原为CaBr2,尿素被氧化为N2,该反应的化学方程式为 。
(2)过滤所需的玻璃仪器有玻璃棒、 , 。
(3)加入氢溴酸调pH的作用是 。
(4)操作I包括 、 、过滤、 、干燥。
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,补充完整检验氢溴酸粗品中是否含有Br2相SO42-的实验方案。
限选下列试剂:氯水、淀粉KI溶液、CCl4、BaCl2溶液、稀盐酸、植物油。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
①参加反应的物质的性质是影响化学反应速率的主要因素②光是影响某些化学反应速率的外界条件之一③决定化学反应速率的主要因素是浓度 ④不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率.
|
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应N2O4(g)⇌2NO2(g)△H=57kJ•mol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )

|
| A. | a、c两点的反应速率:a>c |
|
| B. | a、c两点气体的颜色:a深,c浅 |
|
| C. | 由状态b到状态a,可以用加热的方法 |
|
| D. | a、c两点气体的平均相对分子质量:a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知合成氨的反应为N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4 kJ•mol﹣1.
Ⅰ.在体积为5L的恒温、恒容密闭容器甲中,起始时投入2mol N2、3mol H2,经过10s达到平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅱ.在容器乙中,起始时投入3mol N2、b mol H2,维持恒温、恒压达到平衡,测得平衡时NH3的物质的量为1.2mol.此时与容器甲中平衡状态温度相同,相同组分的体积分数都相同.
(1)容器甲10s内用H2表示的平均反应速率v(H2)= 0.024mol•L﹣1•s﹣1 ,达平衡时N2的转化率= 20% .
(2)甲容器中反应的逆反应速率随时间变化的关系如图.t2时改变了某一种条件,改变的条件可能是 升高了温度 、 增大了氨的浓度 (填写两项).
(3)下列哪些情况表明容器乙已达平衡状态 ACD (填字母).
A.容器乙中的气体密度不再变化
B.氨气的生成速率等于氮气的消耗速率的2倍
C.断裂1mol N≡N键同时断裂6mol N﹣H键
D.容器乙中气体的平均相对分子质量不随时间而变化.

查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.05 mol·L-1 Fe2(SO4)3溶液中含Fe3+数目为0.1NA
B.标准状况下,22.4 L甲苯中含C-H数目为8 NA
C.常温下,9.2 g NO2和N2O4的混合气体中含有的氮原子数目为0.2 NA
D.1 mol氯气和足量NaOH溶液反应转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各物质的学名是:Na2S2O3叫硫代硫酸钠;CaSx叫多硫化钙;Na2O2叫过氧化钠;KO2叫超氧化钾。试综合上述命名规律,分析回答:Na2CS3应读做( )
A.硫代碳酸钠 B.多硫碳酸钠 C.过硫碳酸钠 D.超硫碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
向22.4g的Fe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液600mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A.6.4g B.4.8g C.2.4g D.1.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com