
| A. | 用浓硝酸做试剂比较铁和铜的金属活动性 | |
| B. | 使用干燥洁净玻璃棒将氯水滴在干燥pH试纸上,测定氯水的pH | |
| C. | 欲检验Br-的存在,可在溶液中先加入氯水、再加入CCl4,振荡、静置,观察下层溶液显橙红色 | |
| D. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电荷 |
分析 A.常温下,Fe遇浓硝酸发生钝化;
B.氯水中HClO具有漂白性,使试纸褪色;
C.氯气氧化溴离子,生成溴单质,溶解在四氯化碳中,分层后在下层;
D.胶体不带电荷.
解答 解:A.常温下,Fe遇浓硝酸发生钝化,则应利用盐酸或稀硫酸做试剂比较铁和铜的金属活动性,故A错误;
B.氯水中HClO具有漂白性,使试纸褪色,则应利用pH计测定氯水的pH,故B错误;
C.氯气氧化溴离子,生成溴单质,溶解在四氯化碳中,分层后在下层,则加入CCl4,振荡、静置,观察下层溶液出现橙红色可检验Br-的存在,故C正确;
D.胶体本身不带电荷,但胶体具有吸附性,吸附离子致使胶体微粒带有电荷,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及金属性比较、pH的测定、漂白性、胶体及离子检验、氧化还原反应等,综合性较强,注重高考高频考点的考查,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题
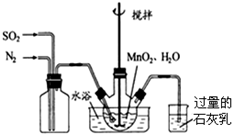
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.
氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铍的最高价氧化物的水化物可能具有两性 | |
| B. | 砹单质是有色固体,砹化氢很不稳定,砹化银是有色难溶于水且感光性很强的固体 | |
| C. | 硫酸锶难溶于水,但易溶于盐酸 | |
| D. | 砷的最高价氧化物的水化物是一种强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | r(Na)>r(Mg)>r(Al)>r(K) | B. | r(K+)>r(Ca2+)>r(S2-)>r(Cl-) | ||
| C. | r(Na)>r(K)>r(Ca)>r(Mg) | D. | r(F-)>r(Na+)>r(Mg2+)>r(Al3+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
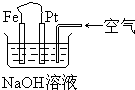
| A. | 这是电解NaOH溶液的装置 | |
| B. | Pt为正极,其电极反应为:O2+2H2O+4eˉ═4OHˉ | |
| C. | Fe为阳极,其电极反应为:Fe-2eˉ+2OHˉ═2Fe(OH)2 | |
| D. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com