
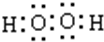 .
.分析 A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N;
E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,则E为S;D与A同主族,且与E同周期,则D为Na;A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,然后利用元素及其单质、化合物的性质来解答.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N;
E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,则E为S;D与A同主族,且与E同周期,则D为Na;A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,
(1)A、C两元素形成的原子个数比为1:1的化合物,为H2O2,电子式为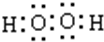 ,故答案为:
,故答案为: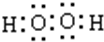 ;
;
(2)氨气在催化剂存在的情况下与氧气反应生成一氧化氮与水,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)X为硝酸铵,为强酸弱碱盐,水解呈酸性,水解的离子方程式为 NH4++H2O?NH3.H2O+H+,故答案为:酸性; NH4++H2O?NH3.H2O+H+;
(4)氧与硫同主族,从上到下非金属性在减弱,则非金属性O>S,可以利用与氢气化合的难易程度及气态氢化物的稳定性、单质的氧化性等来判断,氢化物沸点、单质的状态都属于物理性质,不能比较非金属性强弱,故AB错误、CD正确,
故答案为:氧; CD;
(5)C、D两元素形成的原子个数比为1:1的化合物为Na2O2,E、C两元素形成的原子个数比为1:2的化合物为SO2,过氧化钠具有强氧化性,二者反应生成硫酸钠,反应的化学方程式为:Na2O2+SO2═Na2SO4,
故答案为:Na2O2+SO2═Na2SO4;
(6)H与O、H与S可分别形成甲、乙两种负一价双原子离子,且甲有10个电子,乙有18个电子,则甲为HO-,乙为HS-,离子反应为HS-+OH-═S2-+H2O,
故答案为:HS-+OH-═S2-+H2O.
点评 本题考查位置结构性质的应用,为高考常见题型,侧重于学生的分析能力的考查,掌握元素单质化合物的性质来推断元素是解答本题的关键,学生只要熟悉常见的化合物即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、NO3- | B. | Na+、Mg2+、NO3- | ||
| C. | Cr2O72-、Ba2+、Cl- | D. | K+、Na+、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰熔化时水分子中共价键发生断裂 | |
| B. | 原子晶体中共价键越强硬度越大 | |
| C. | 晶体中分子间作用力越大,分子越稳定 | |
| D. | 氯化钠溶于水时离子键未被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | 只有① | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物只能来自于有生命力的动、植物 | |
| B. | 德国化学家维勒首次用无机物氰酸铵合成了有机物尿素 | |
| C. | 德国化学李比希最先提出有机物的定量分析方法 | |
| D. | 荷兰化学家范特霍夫最先提出CH2Cl2没有同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,阳极附近溶液的pH增大 | |
| B. | 充电时,转移1 mol电子时阴极增加的质量为103.5 g | |
| C. | 放电时,BF4-向PbO2电极移动 | |
| D. | 放电时,正极的电极反应式为Pb+2e-+2H2O═Pb2++4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
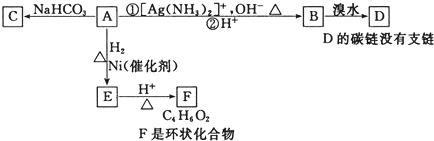
| A. | 化合物A中一定含有的官能团是醛基、羧基和碳碳双键 | |
| B. | 由A生成E发生还原反应 | |
| C. | F的结构简式可表示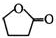 | |
| D. | 由B生成D发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 在过氧化钠中加入稀硫酸:O22-+4H+═2H2O+O2↑ | |
| C. | 澄清石灰水与过量的小苏打溶液反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com