
分析 ①由HA═H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7;
②温度升高促进电离;
③HA电离出的c(H+)为0.1mol/L×0.1%,利用Kw来计算水电离产生的氢离子浓度.
解答 解:①由HA═H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为Ka=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7,故答案为:1×10-7;
②因HA的电离是吸热过程,温度升高促进电离,A-离子、氢离子浓度越大,则K增大,故答案为:增大;
③HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,水电离产生的氢氧根离子为$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L,而水电离氢离子浓度等于氢氧根离子的浓度,c(H+)为10-10mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍,故答案为:106.
点评 本题考查弱酸的电离,为高频考点,侧重于学生的分析能力和计算能力的考查,明确离子的浓度、温度对电离平衡的影响及离子积的计算即可解答,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,铝遇冷浓硝酸钝化 | B. | 浓盐酸的质量减轻 | ||
| C. | 澄清的石灰水变浑浊 | D. | 氢氧化钠固体发生潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
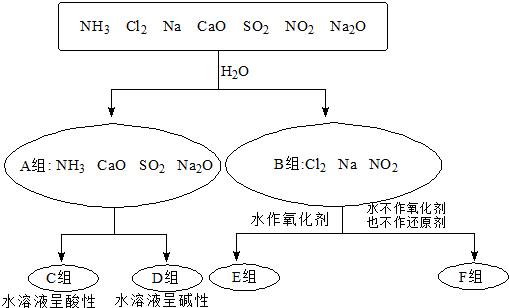
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电离平衡正向移动,c(H+)增大 | |
| B. | HF的电离程度增大,c(H+)、c(F-)增大,c(HF)减小 | |
| C. | 稀释过程中,c(OH-)增大 | |
| D. | 溶液的KW、pH均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
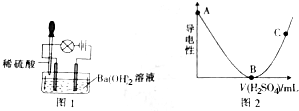
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2878KJ/mol | B. | 2658KJ/mol | C. | 1746KJ/mol | D. | 1526KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com