

分析 (1)玻璃棒在化学实验中的作用是:搅拌和引流;
(2)氯化钡可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,加入盐酸可以除去过量的碳酸钠和氢氧化钠;
(3)难溶物质和溶液的分离采用过滤的方法;
(4)用氢氧化钾会引进杂质钾离子;
(5)第②、③步分别为钡离子与硫酸根离子反应生成硫酸钡沉淀、氢氧根离子与镁离子反应生成氢氧化镁沉淀,据此写出反应的离子方程式.
解答 解:(1)在粗盐提纯时,用玻璃棒溶解,玻璃棒的作用是搅拌,加速粗盐的溶解,过滤是将固体和液体进行分离的一种操作,玻璃棒在其中的作用是引流,
故答案为:搅拌,加速粗盐的溶解;引流;
(2)氯化钡可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,步骤②是为了除去硫酸钠,第⑥步操作加入盐酸,盐酸与氢氧化钠生成氯化钠和水,与碳酸钠生成氯化钠、二氧化碳和水,
故答案为:Na2SO4;NaOH;Na2CO3;
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3以及BaCO3,
故答案为:BaCO3;
(4)加入氢氧化钠,可以除去溶液中的氯化镁,发生反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,选择的除杂试剂不能用KOH代替NaOH,否则会引入钾离子,
故答案为:会引入新的杂质KCl;
(5)第②步中加入氯化钡溶液,目的是除去粗盐中的硫酸根离子,反应的离子方程式为:Ba2++SO42-=BaSO4↓;
第③步中加入过量的氢氧化钠,目的是除去杂质镁离子,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,
故答案为:Ba2++SO42-=BaSO4↓;Mg2++2OH-=Mg(OH)2↓.
点评 本题考查了粗盐的提纯,题目难度不大,注意除杂质时不要引入新的杂质,明确粗盐提纯试剂的加入顺序是解答本题的关键,试题培养了学生的化学实验能力.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题

| A. | 溶液B中发生的反应为:2SO2+O2→2SO3 | |
| B. | 由反应过程可推知氧化性:O2>Fe3+>SO42- | |
| C. | 溶液的pH:A>B>C | |
| D. | A溶液到C溶液,Fe3+浓度变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3中含有O数目为3.0NA | |
| B. | 常温常压下,12.2gNaHSO4中含有离子总数为0.3NA | |
| C. | 在1L 0.1mol•L-1碳酸钠溶液中,阴离子总数大于0.1NA | |
| D. | 某密闭容器盛有0.1mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯分子的电子式: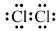 | |
| B. | 氯离子(Cl-)的结构示意图: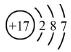 | |
| C. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}Cl$ | |
| D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
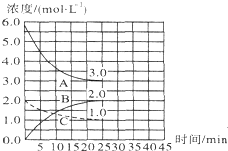 目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1
目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com