
| A. | 用Ba(N03)2溶液鉴别CaCl2溶液和(NH4)2SO4溶液 | |
| B. | 用稀硫酸鉴别碳酸钠固体和碳酸钾固体 | |
| C. | 用湿润的蓝色石蕊试纸鉴别氨气和氢气 | |
| D. | 用淀汾溶液鉴别加碘盐(含KI03)和未加碘盐 |
分析 A.硝酸钡不与氯化钙反应,但能够与硫酸铵反应生成硫酸钡沉淀;
B.稀硫酸与碳酸钠、碳酸钾的反应现象相同;
C.湿润的蓝色石蕊试纸不与氨气和氢气都没有明显现象;
D.碘单质遇到淀粉显示蓝色,不是碘元素.
解答 解:A.CaCl2与Ba(N03)2不反应,而(NH4)2SO4与Ba(N03)2反应生成沉淀,可用Ba(N03)2溶液鉴别CaCl2溶液和(NH4)2SO4溶液,故A正确;
B.碳酸钾和碳酸钠都与稀硫酸反应生成气体,无法用稀硫酸鉴别二者,故B错误;
C.氨气和氢气都不能使湿润的蓝色石蕊试纸变色,应该用红色石蕊试纸,故C错误;
D.碘单质能够使淀粉变蓝,而KI03不能使淀粉变蓝,无法用淀粉鉴别加碘盐和未加碘盐,故D错误;
故选A.
点评 本题考查物质的检验和鉴别,为高频考点,题目难度中等,侧重于学生的分析能力和实验能力的考查,注意利用不同现象鉴别物质为解答关键,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 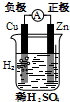 Cu-Zn原电池 | B. | 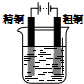 CuSO4溶液粗铜的精炼 | ||
| C. |  NnCl2溶液铁片镀锌 | D. | 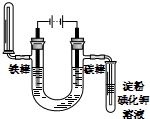 饱和NaCl溶液验证气体产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
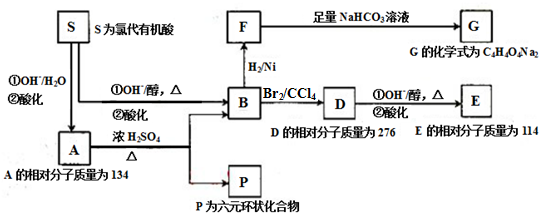
 .
.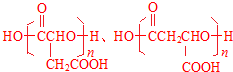 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数为0.1NA 的N2 和NH3 混合气体,原子间含有的共用电子对数目为0.3NA | |
| B. | 2 mol SO2 和1 mol O2 在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 1.5 mol NO2 与足量水反应,转移的电子数为1.5NA | |
| D. | 常温条件下,分子数为NA 的CO、N2混合气体质量为28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W分子中碳、氢质量比为1:2 | B. | W同分异构体有5种 | ||
| C. | 经红外光谱测定W最多有4个甲基 | D. | 在核磁共振氢谱中W最少有2个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na202与足量H20反应生成标况下11.2L 02.转移电子的数目为2NA | |
| B. | 标准状况下,2.24L S03中所含电子数为4NA | |
| C. | 用惰性电极电解CuS04溶液后,如果加入0.1mol Cu(0H)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| D. | 0℃和101kp的条件下,1.12L甲烷完全燃烧生成的水分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
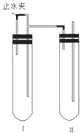 用下面两种方法可以制得白色的Fe(OH)2沉淀.
用下面两种方法可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | Na2O2与CO2反应,Na2O2是氧化剂、CO2是还原剂 | |
| C. | 向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液.则放出氢气的体积(同温同压下)不相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com