
分析 (1)干冰中碳原子与氧原子之间形成2对共用电子对;
(2)由题目信息可知,CO2与NH3反应生成NH2COONH4;
(3)NH2COONH4转化为CO(NH2)2,由原子守恒可知还生成H2O;
(4)CO2中碳元素化合价为+4价,具有氧化性,H2具有还原性;
(5)NaHCO3、Fe与H2O反应可生成CH4,C元素发生还原反应,则Fe发生氧化反应生成四氧化三铁,还应有NaOH生成;
(6)一份固体加入减轻的质量为结晶水的质量及碳酸氢钠分解生成的二氧化碳、水的质量质量之和;另一份加入酸后用石灰水吸收气体,生成的10g白色沉淀为碳酸钙的质量,结合每份样品总质量列方程计算解答;
(7)BaSO4与碳酸钠反应得到BaCO3与硫酸钠.
解答 解:(1)干冰中碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,
故答案为:O=C=O;
(2)由题目信息可知,CO2与NH3反应生成NH2COONH4,反应方程式为:CO2+2NH3═NH2COONH4,
故答案为:CO2+2NH3═NH2COONH4;
(3)NH2COONH4转化为CO(NH2)2,由原子守恒可知还生成H2O,反应方程式为:NH2COONH4 $\frac{\underline{\;\;△\;\;}}{\;}$ CO(NH2)2+H2O,
故答案为:NH2COONH4 $\frac{\underline{\;\;△\;\;}}{\;}$ CO(NH2)2+H2O;
(4)CO2中碳元素化合价为+4价,具有氧化性,H2具有还原性,所以从氧化还原反应的角度说明该推测具有一定的合理性,
故答案为:CO2中碳元素化合价为+4价,具有氧化性,H2具有还原性,所以从氧化还原反应的角度说明该推测具有一定的合理性;
(5)NaHCO3、Fe与H2O反应可生成CH4,C元素发生还原反应,则Fe发生氧化反应生成四氧化三铁,还应有NaOH生成,反应方程式为:NaHCO3+3Fe+2H2O$\frac{\underline{\;高温高压\;}}{\;}$CH4+NaOH+Fe3O4,
故答案为:NaHCO3+3Fe+2H2O$\frac{\underline{\;高温高压\;}}{\;}$CH4+NaOH+Fe3O4;
(6)设11.30g矿物中Na2CO3、NaHCO3、H2O的物质的量分别为amol、bmol、cmol,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 固体质量减少
2mol 62g
bmol 31b g
则31b+18c=11.3-7.95=3.35
另一份加入酸后用石灰水吸收气体,生成的10g白色沉淀为碳酸钙的质量,根据碳原子守恒则a+b=$\frac{10}{100}$=0.1
由样品质量可得:106a+84b+18c=11.3,
联立方程解得a=0.05、b=0.05、c=0.1,
故该矿物的化学式是Na2CO3•NaHCO3•2H2O,
故答案为:Na2CO3•NaHCO3•2H2O;
(7)BaSO4不溶于酸,若用饱和Na2CO3溶液处理可转化为溶于酸的BaCO3,沉淀转化反应的离子方程式是:BaSO4+CO32-=BaCO3+SO42-,
故答案为:BaSO4+CO32-=BaCO3+SO42-.
点评 本题考查混合物计算、化学方程式书写、氧化还原反应、沉淀转化等,是对学生综合能力的考查,难度中等.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:选择题
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
| A. | 实验①中铁钉只做还原剂 | |
| B. | 实验②中Fe2+既显氧化性又显还原性 | |
| C. | 实验③中发生的是置换反应 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
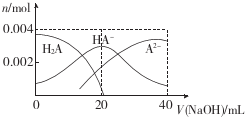
| A. | 当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(HA-)>c( A2-)>c( OH-)>((H+) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大 | |
| C. | 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大 | |
| D. | 当V(NaOH)=40 mL时,升高温度,$\frac{c(N{a}^{+})}{c({A}^{2-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 (g)+2NO2 (g)═N2 (g)+CO2 (g)+2H2 O(g)△H=-867 kJ•mol-1 | |
| B. | CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2O(l)△H3<△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
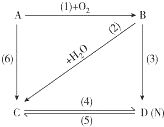 图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式:
图中A是一种金属单质,B是淡黄色固体,D的焰色反应呈黄色;试指出A、B、C、D是何种物质,并写出有关的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 向硫酸溶液中加入Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲利用如图所示装置自制氢氧燃料电池.
某课外兴趣小组欲利用如图所示装置自制氢氧燃料电池.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com