
| A. | 136.8kJ | B. | 110.9kJ | C. | 83.2kJ | D. | 82.4kJ |
分析 用1.5molN2和一定量H2反应时,当N2的转化率为80%,据此可计算出平衡时消耗氮气的物质的量,然后结合热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol进行计算.
解答 解:N2的转化率为80%,则平衡时消耗氮气的物质的量为:1.5mol/L×80%=1.2mol,
根据N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol可知,消耗1mol氮气放出92.4kJ的热量,则消耗1.2mol氮气放出的热量为:92.4kJ/mol×1.2mol=110.88kJ≈110.9kJ,
故选B.
点评 本题考查反应热与焓变的计算,题目难度不大,明确可逆反应特点为解答关键,注意掌握热化学方程式表示的意义及计算方法,试题培养了学生的分析能力及化学计算能力.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入氯水振荡,观察水层是否有红棕色出现 | |
| B. | 滴入 AgNO3溶液,再加入稀 HNO3,观察有无浅黄色沉淀生成 | |
| C. | 加入 NaOH 溶液共热,然后加入稀 HNO3使溶液呈酸性,再滴入 AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入 NaOH 溶液共热,冷却后加入 AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据元素在周期表中的位置,推测元素的原子结构 | |
| B. | 指导新元素的发现和合成,预测新元素的性质 | |
| C. | 在金属与非金属的分界线附近寻找半导体材料 | |
| D. | 在零族元素中寻找耐腐蚀的金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A2)=0.4 mol•L-1•s-1 | B. | v(D)=6 mol•L-1•min-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(B2)=0.8 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,棕黄色
,棕黄色 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
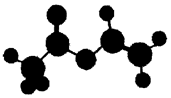 法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物与Br2的四氯化碳溶液不反应 | |
| C. | 该化合物既能发生水解反应,又能发生缩聚反应 | |
| D. | 该化合物的链状同分异构体中,能与NaHCO3反应放出CO2的只有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2(c1<c2),则时间间隔为 t1~t2内(t1<t2,以秒为单位),SO3(g)生成的平均速率为v=$\frac{({c}_{2}-{c}_{1})}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
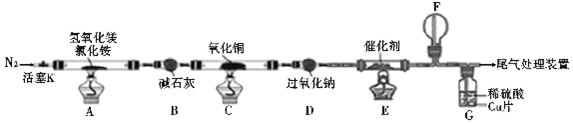
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该浓硝酸中HNO3的物质的量浓度是14.0mol/L | |
| B. | 加入NaOH溶液的体积是50mL | |
| C. | 浓硝酸在与合金反应中起了酸性和氧化性的双重作用 | |
| D. | 得到的金属氢氧化物的沉淀为3.12克 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com