
【题目】下列物质只含有离子键的是
A. CO2B. Na2SC. H2SO4D. KOH
科目:高中化学 来源: 题型:
【题目】已知:① A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平 ② ![]() 。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
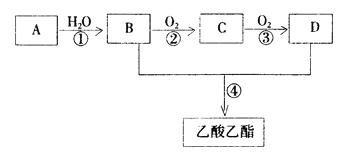
回答下列问题:
(1)B、D分子中的官能团名称分别是 __________、___________。
(2)写出下列反应的反应类型:①__________,②__________,④________。
(3)写出下列反应的化学方程式:
②____________________________;④_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或设计中,可行的是( )
A. CO2通入足量BaCl2溶液中,产生白色沉淀
B. 除去O2中混有的H2,可将气体通过灼热CuO
C. 利用分液斗可分离酒精和氯化钠的混合物
D. 加稀盐酸后过滤,除去铜扮中没有的少量镁粉和铝粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界上最早现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载。回答下列问題:
(1)基态Zn原子的电子占据能量最高的能层符号为_________,与Zn同周期的所有副族元素的基态原子中,最外层电子数与Zn相同的元素有_________种。
(2)硫酸锌溶于过量的氨水可形成[Zn(NH3)4]SO4溶液。
①在[Zn(NH3)4]SO4中,阴离子的中心原子的轨道杂化类型为______________;
②在[Zn(NH3)4]SO4中,与Zn2+形成配位键的原子是______________________(填元素名称);
③写出一种与SO42-互为等电子体的分子的化学式__________________;
④NH3极易溶于水,除因为它们都是极性分子外,还因为__________________。
(3)Zn与S所形成化合物晶体的晶胞如图所示。

①与Zn原子距离最近的Zn原子有___________个;
②该化合物的化学式为___________;
③已知该晶体的晶胞参数a=541 pm,其密度为_______g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比是8∶1∶2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是
A.1∶1∶1 B.1∶4∶2 C.1∶2∶4 D.1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量是衡量一个国家石油化工发展水平标志,下图是以A为原料生产某些化工产品的转化关系图.

据此回答下列问题.
(1)写出A的结构简式_________________.D中官能团的名称________________
(2)反应①的反应类型___________________
(3)写出反应③的方程式的______________________________________________________
(4)写出C的属于酯类的同分异构体的结构简式_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下:
金属离子 | 开始沉淀时的pH | 沉淀完全时的pH |
Fe3+ | 1. 1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Al3+ | 3.0 | 5.0 |
Ni2+ | 6.7 | 9.5 |
物质 | 20℃时溶解性(H2O) |
CaSO4 | 微溶 |
NiF | 可溶 |
CaF2 | 难溶 |
NiCO3 | Ksp= 1.0×10-5 |
(1)NH4F的电子式为____________。
(2)将含镍原料粉碎的目的是____________。
(3)调节pH步骤中,溶液pH的调节范围是____________。
(4)滤渣1和滤渣3主要成分的化学式分别是____________、_____________。
(5)写出氧化步骤中加入H2O2发生反应的离子方程式_____________。
(6)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_______________。
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、_______min。

(8)沉镍过程中,若c(Ni2+)=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5span>mol·L-1],则需要加入Na2CO3固体的质量最少为______g。(保留小数点后1位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com