
| A. | 3n | B. | 3n+1 | C. | 2n | D. | 2n+1 |
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
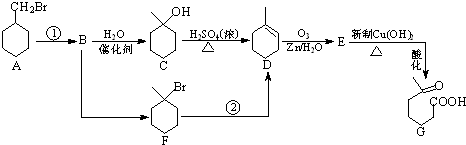
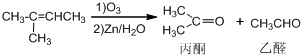
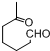 +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$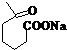 +Cu2O↓+3H2O;
+Cu2O↓+3H2O; 物质D与呋喃(
物质D与呋喃(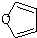 )也可以发生“Diels-Alder反应”,该化学反应方程式为
)也可以发生“Diels-Alder反应”,该化学反应方程式为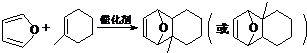 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液呈碱性的原因:HCO3-+H2O?CO32-+H3O+ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀质量最大:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 氢氧化铝溶于醋酸溶液:Al(OH)3+3H+═Al3++3H2O | |
| D. | 氯化铝溶液中加入过量氨水Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2 | |
| B. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1,则金刚石比石墨稳定 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则含20 g NaOH的稀溶液与稀醋酸恰好完全反应,放出的热量为28.7 kJ | |
| D. | 2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则碳的燃烧热等于110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能由pH=2的盐酸与pH=12的氨水等体积混合而成 | |
| B. | 该溶液可能由等物质的量浓度的盐酸和氨水等体积混合而成 | |
| C. | 加入适量氨水,溶液中离子浓度可能为:c (NH4+)>c (Cl-)>c (OH-)>c(H+) | |
| D. | 该溶液中c (NH4+)=c (Cl-)+c (OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
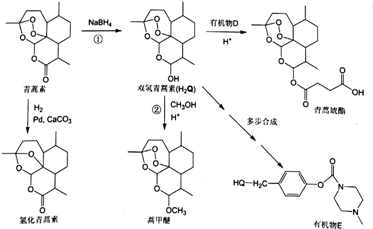
 (或
(或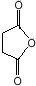 ).
). .
.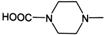 外,还需含苯环的二羟基化合物P,其结构简式为
外,还需含苯环的二羟基化合物P,其结构简式为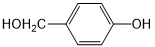 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式
.化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 (或
(或 ,其他合理答案亦可).
,其他合理答案亦可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
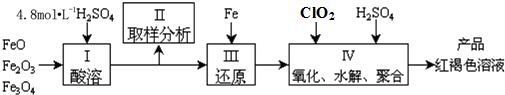
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com