
| A. | 工业废水经处理达标后再排放 | B. | 农业生产中农药、化肥正确使用 | ||
| C. | 禁止使用化肥、农药 | D. | 城市垃圾妥善处理 |
分析 工业废水、垃圾、农药、化肥均可造成水体污染,废水、垃圾应处理后排放,而农药、化肥要合理使用,以此来解答.
解答 解:A.工业废水经处理达标后再排放,不含有毒重金属离子、腐蚀性等,可防止水体污染,故A不选;
B.农业生产中农药、化肥正确使用,防止药物残留,N、P元素使水中藻类植物大量生长,可防止水体污染,故B不选;
C.禁止使用化肥、农药,做法不合理,对害虫应使用农药、对土壤应合理使用化肥,改善土壤结构,故C选;
D.城市垃圾妥善处理,尤其医疗垃圾应集中处理,可防止水体污染,故D不选;
故选C.
点评 本题考查三废处理及环境保护,为高频考点,把握常见的环境污染物、水体污染的途径为解答的关键,侧重分析与应用能力的考查,注意化学与环境的联系,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 胶体区别与其他分散系的本质特征是分散质的粒子直径在1-100nm之间 | |
| B. | 用平行光照射CuSO4溶液和氢氧化铁胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴到NaOH溶液中,一制取氢氧化铁胶体 | |
| D. | 树林中的晨曦,该现象与丁达尔效应有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (改编)苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
(改编)苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为: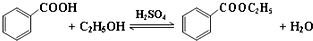
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
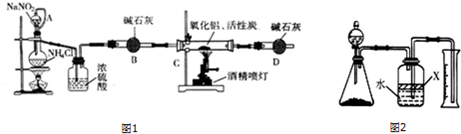
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
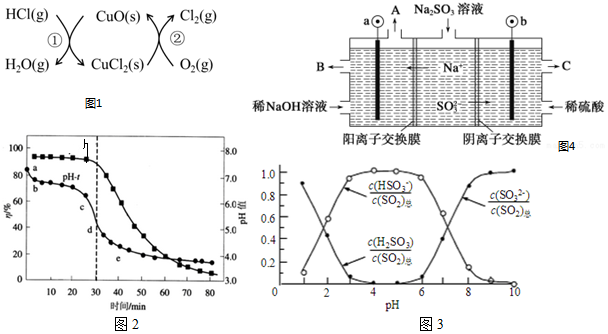
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高烟囱排放 | B. | 用氨水吸收后排放 | ||
| C. | 用烧碱吸收后排放 | D. | 用活性炭吸收后排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | |
| B. | 在由水电离出的c(H+)=1×10-12mol/L的溶液:Fe3+、ClO-、Na+、SO42- | |
| C. | 加入金属铝产生H2的溶液中:Na+、K+、SO42-、Cl- | |
| D. | 饱和氯水中:Cl-、Na+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO3-、Al3+、K+ | B. | Na+、ClO3-、ClO-、ClO4- | ||
| C. | K+、Cr2O72-、I-、Na+ | D. | Na+、SO32-、SO42-、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com